
【题目】材料科学发展日新月异。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____________。某镍配合物结构如图5所示,分子内含有的作用力有_______________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(2)某金属M与C60可制备一种超导材料,晶胞如图1所示,M原子位于晶胞的棱上与内部。该材料的化学式为__________________。
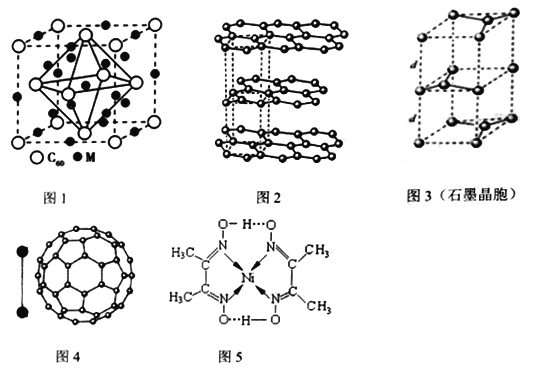
(3)碳的一种同素异形体——石墨,其晶体结构如图2所示,碳原子的杂化方式_____________,图3虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________________个。
(4)有机太阳能固体电池材料含有高纯度C60,其结构如图4,1molC60分子中π键的数目为_______,C60的晶胞结构如图4,则一个C60分子周围有_________个紧邻C60分子,其固体属于___________晶体。C60能在溶剂二硫化碳中溶解而不溶于水的原因是_________________。已知该晶胞的密度为ρ g·cm-3则两个最近C60间的距离为_________________nm(列出计算式,已知阿伏伽德罗常数的值为NA)。
【答案】 3d84s2 :ACE M3C60 sp2 4 30NA 12 分子 C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子  ×107
×107
【解析】本题考查《物质结构与性质》,(1)Ni位于VIII族,即Ni的价电子包括最外层电子和次外层的d能级,Ni的价电子排布式为3d84s2,根据图5的Ni和N之间存在配位键,N=C、C-C、N-O、C-H、O-H之间是共价键或极性共价键,O…H之间存在氢键,故选项ACE正确;(2)C60位于晶胞的顶点和面心,个数为8×1/8+6×1/2=4,M位于棱上和体心,个数为12×1/4+9=12,化学式为M3C60;(3)根据图2,石墨中碳原子形成3个C-C,无孤电子对,因此杂化类型为sp2,根据图3碳原子位于顶点、棱上、面心、体心,因此个数为8×1/8+4×1/4+1+2×1/2=4;(4)C60中一个碳原子有2个C-C,1个C=C,根据均摊法,1个碳原子有1/2个π键,1molC60中含有π键的数目是60×1/2×NA=30NA,C60属于分子晶体,一个C60分子周围有12个紧邻的C60,C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子;C60的晶胞与干冰的晶胞相似,设棱长为acm,晶胞的质量为(8×1/8+6×1/2)×720/NAg=2880/NAg,晶胞的体积为a3cm3,根据密度的定义,ρ=2880/NA a3,a=  ,两个最近C60间距离是面心对角线的一半,即
,两个最近C60间距离是面心对角线的一半,即![]() ×
× ×107nm。
×107nm。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 风化、液化、氧化、酸化都是化学反应
B. 碱性氧化物一定是金属氧化物
C. NH4Cl、HCl中均含共价键,二者均为共价化合物
D. 需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成化合物D。
(1)易与C发生化学反应的酸是________,写出反应的化学方程式:_________________。
(2)C与纯碱混合高温熔融时生成D和气体E;将生成的全部气体E通入全部D溶于足量的水得到的溶液中,又发生化学反应生成化合物F。
①分别写出上述过程中,生成D和生成F的化学反应方程式:_____________、___________。
②要将纯碱高温熔化,下列坩埚中可选用的是______(填序号)。
a.普通玻璃坩埚 b.石英玻璃坩埚 c.氧化铝坩埚 d.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现向等浓度NaCl和NaBr的混合溶液中逐滴加入稀AgNO3溶液,先沉淀的是
A. AgCl B. AgBr C. 同时沉淀 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
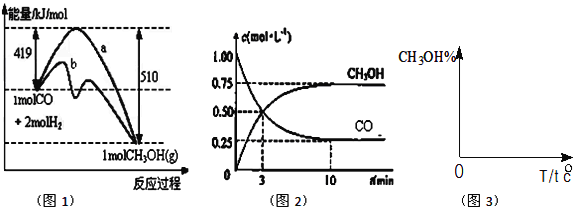
(1)在图1中,曲线_______(填:a或b)表示使用了催化剂;该反应属于_______(填:吸热、放热)反应。
(2)下列说法正确的是______________A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时 n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=________;在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在图3中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线_______________(在曲线上标出P1、P2,且P1<P2)。
(5)有一类甲醇质子交换膜燃料电池,工作时将甲醇转化为甲酸,该电池的负极反应式为_______________。
(6)已知CO、H2的燃烧热为283kJ/mol、285.8kJ/mol,写出CH3OH(g)燃烧热的热化学方程式__________________。
(7)常温下,用0.1000 molL-1NaOH溶液滴定20.00mL0.1000 molL-1CH3COOH溶液所得滴定曲线如图,则点①所示溶液中,关于CH3COOH、CH3COO-、H+、OH-4种微粒的等式为:____________
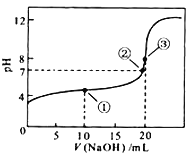
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液:①NH4Cl ②(NH4)2Fe(SO4)2 ③(NH4)2SO4 ④CH3COONH4⑤NH4HSO4中,c(NH4+)由大到小的顺序为
A. ②③①⑤④ B. ②③⑤①④ C. ⑤④①③② D. ②③①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 速率之比ν(A2) :ν(B2) :ν(AB)=1:1:2
B. 浓度之比c(A2): c(B2): c(AB)=1:1:2
C. 单位时间内生成2n mol AB,同时消耗n mol A2
D. 各物质的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.CO2的水溶液可以导电,CO2是电解质
B.硫酸钡难溶于水,但却是电解质
C.氯化钠溶液在电流的作用下电离成钠离子和氯离子
D.溶于水后能电离出氢离子的化合物都是酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com