
【题目】下列叙述正确的是
A. 风化、液化、氧化、酸化都是化学反应
B. 碱性氧化物一定是金属氧化物
C. NH4Cl、HCl中均含共价键,二者均为共价化合物
D. 需要加热才能发生的反应一定是吸热反应
科目:高中化学 来源: 题型:
【题目】常温下,将0.01molNH4Cl和0.005molNaOH溶于水配成1L溶液(pH>7).
(1)该溶液中存在的三个平衡体系是 、 、 。
(2)溶液中存在的离子物质的量浓度由大到小顺序为 。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.005mol/L的是 。
(4)物质的量之和为0.0lmol的二种粒子是 。
(5)NH4+和H+两种粒子物质的量之和比OH-多 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按酸、碱、混合物、电解质的顺序组合的一组是
A. 氢氟酸、纯碱、空气、液氨
B. 硝酸、烧碱、水玻璃、硫酸钡
C. 醋酸、熟石灰,胆矾、小苏打
D. 硫酸、碱式碳酸铜、汽油、草木灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为六种常见的短周期主族元素,原子序数依次增大。A、B能写出两种常温下均呈液态的化合物,D原子核外的M层上有3个电子,A、C同主族,B、E同主族。根据信息回答下列问题:
(1)D在元素周期表中的位置为_______。
(2)六种元素中,原子半径最大的是__________(填元素符号)。
(3)B对应的氢化物的沸点高于E对应的氢化物,主要原因是__________。
(4)由A分别和B、E、F所形成的三种化合物中,热稳定性最差的是__________(填化学式)。
(5)由A、B形成的两种化合物中,一种物质可以转化为另外一种物质,反应的化学方程式为____________________ 。
(6)F对应的单质常用于自来水消毒,该单质与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源和作为能源的物质叙述错误的是( )
A. 化石能源物质内部蕴涵着大量的能量
B. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C. 吸热反应是反应物总能量大于生成物的总能量
D. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A. | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
B. | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C. | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀。 | 酸性:H2CO3 >H2SiO3 |
D. | 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3-结合H+的能力比 SO32-的强 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中可以大量共存的是
A. H+、AlO2-、Cl-、S2- B. Na+、K+、NH4+、CO32-
C. Br-、Al3+、Cl-、HCO3- D. Ba2+、OH-、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应化学方程式中![]() =______。
=______。
(2)t1到t2时刻,以N的浓度变化表示的平均反应速率为:______。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中M与N的物质的量之比为1︰1
B.N的质量分数在混合气体中保持不变
C.单位时间内每消耗a mol N,同时生成b mol M
D.混合气体的总物质的量不随时间的变化而变化
E.混合气体的压强不随时间的变化而变化
F.混合气体的总质量不随时间的变化而变化
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是____,t2~t3速率变化的主要原因是___。
(2)实验②放出氢气的量减少的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料科学发展日新月异。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____________。某镍配合物结构如图5所示,分子内含有的作用力有_______________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(2)某金属M与C60可制备一种超导材料,晶胞如图1所示,M原子位于晶胞的棱上与内部。该材料的化学式为__________________。
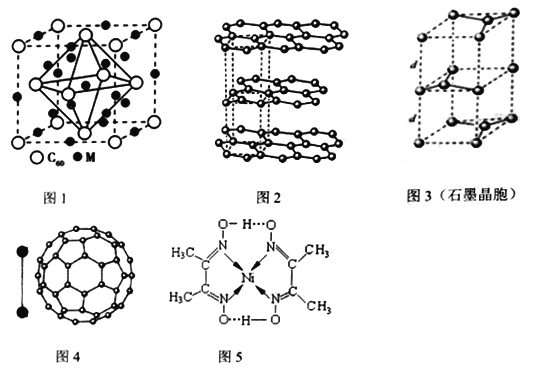
(3)碳的一种同素异形体——石墨,其晶体结构如图2所示,碳原子的杂化方式_____________,图3虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________________个。
(4)有机太阳能固体电池材料含有高纯度C60,其结构如图4,1molC60分子中π键的数目为_______,C60的晶胞结构如图4,则一个C60分子周围有_________个紧邻C60分子,其固体属于___________晶体。C60能在溶剂二硫化碳中溶解而不溶于水的原因是_________________。已知该晶胞的密度为ρ g·cm-3则两个最近C60间的距离为_________________nm(列出计算式,已知阿伏伽德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com