
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
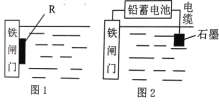
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
【答案】负极2Fe-4e-=2Fe2+ 正极O2+4e-+2H2O=4OH- B 负 0.1mol
【解析】
(1) 该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应;
(2) 原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
(3) 在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(4) 电解后溶液的 pH 为 13,即c(OH-)=0.1mol/L,溶液中n(OH-)=0.1mol,结合2Cl-+2H2O=Cl2↑+H2↑+2OH-计算转移电子的物质的量。
(1) 该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+2H2O+4e-=4OH-;
(2) 为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,但Na极易与水反应,则与铜和石墨都不能做电极材料,故答案为B;
(3) 电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极;
(4) 电解后溶液的 pH 为13,即c(OH-)=0.1mol/L,溶液中n(OH-)=0.1mol,由2Cl-+2H2O=Cl2↑+H2↑+2OH-可知,反应中生成的n(OH-)为0.1mol,则被氧化的Cl-的物质的量为0.1mol,故转移电子的物质的量为0.1mol。


科目:高中化学 来源: 题型:
【题目】如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是( )
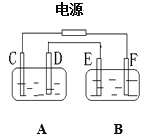
A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应
C.E极应为粗铜板材料
D.B池中E极质量增加12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市主要空气污染物为![]() 、
、![]() 、
、![]() 科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:

下列判断不正确的是
A.上述实验中可用![]() 代替
代替![]() ,以证明待测试样中含
,以证明待测试样中含![]()
B.由实验![]() 可知待测试样中含有
可知待测试样中含有![]() 和
和![]()
C.焰色反应表明待测试样中含Na元素和K元素
D.该城市的污染来源主要是燃煤和机动车尾气排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可形成离子化合物Y2O和Y2O2。
(1)Y2Z的电子式是 ________
(2)实验室可用如图所示装置制备并收集XH3(缺少收集装置,夹持固定装置略去)。

①图中方框内应选用连接_____烧瓶收集XH3(填“A或B”)。
②实验室制法中大试管中的试剂一般选用(填写化学式)_________________。烧杯中溶液由无色变为红色,其原因是(用电离方程式表示):___________________________________
③XH3是工业上氧化法制硝酸的重要基础原料,制备过程中该物质发生的化学反应方程式为__________________________。
(3)磷在W2中燃烧可生成两种产物,其中一种产物甲,分子中各原子最外层不全是8电子结构,甲的化学式是_________。 XH3和HW两种化合物能反应生成离子化合物乙,n mol甲与n mol乙在一定条件下反应,生成4n mol HW和另一化合物,该化合物蒸气的密度是相同状况下氢气密度的174倍,其化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+![]() O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
B.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
C.500℃下,将0.5mol I2(g)和0.5molH2(g)置于密闭的容器中充分反应生成HI(g),放热10kJ,其热化学方程式为:I2(g) + H2(g)![]() 2HI(g) △H = -20kJmol-1
2HI(g) △H = -20kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油是人类目前使用的主要能源,同时也是重要的化工原料。
Ⅰ.石油经分馏、裂化、裂解可以获得C4H10、CH4、C3H6、C2H6、C2H4等许多重要的化工原料。
已知:i.C4H10(g)![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
ii.C4H10(g)![]() C2H6(g)+C2H4(g)
C2H6(g)+C2H4(g)
CH3CH2CH2CH3与![]() 的平衡转化率随温度变化的关系如图1所示。
的平衡转化率随温度变化的关系如图1所示。

(1)![]() 的名称是___;其一氯代物有___种,结构简式分别是___。
的名称是___;其一氯代物有___种,结构简式分别是___。
(2)660℃时,取1molCH3CH2CH2CH3通入2L恒容密闭容器中发生反应i、ii,经过30min达到平衡,C2H6的体积分数为![]() 。
。
①达平衡时反应物转化率为___,30min内,用C2H6表示的平均反应速率v(C2H6)为___。
②达到平衡时,CH4的物质的量分数为___%(精确到0.1)。
Ⅱ.用煤干馏得到的二甲苯和乙烯为原料合成涤纶(聚酯纤维)的路线如下:

(3)①写出A![]() B的化学方程式:__,反应类型是___。
B的化学方程式:__,反应类型是___。
②若1mol![]() 与1mol
与1mol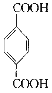 酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。图中表示两个常见的固氮反应:
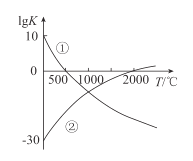
①![]()
②![]() 的平衡常数
的平衡常数![]() 与温度的关系,根据图中的数据判断下列说法正确的是( )
与温度的关系,根据图中的数据判断下列说法正确的是( )
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______________________________;
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com