
【题目】已知X、Y、Z、M、R五种元素中,原子序数依次增大,其结构或性质信息如下表。请根据信息回答有关问题:
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 在元素周期表的各元素中电负性仅小于氟 |
M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子 |
R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
(1)元素M的原子核外有 ______ 种不同运动状态的电子;
(2)五种元素中第一电离能最高的是_______写元素符号;
(3)在Y形成的单质中,![]() 键与
键与![]() 键数目之比为______,在
键数目之比为______,在![]() 中Z原子的杂化方式为_____,其分子的空间构型为 ______;
中Z原子的杂化方式为_____,其分子的空间构型为 ______;
(4)R的一种配合物的化学式为![]() 。已知
。已知![]() 在水溶液中用过量硝酸银溶液处理,产生
在水溶液中用过量硝酸银溶液处理,产生![]() AgCl沉淀,此配合物最可能是 ______填序号。
AgCl沉淀,此配合物最可能是 ______填序号。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】 17 N 1:2 ![]() V型 B
V型 B
【解析】
已知X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,X元素原子原子的L层上s电子数等于p电子数,核外电子排布为![]() ,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为
,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为![]() ,则Y为N元素;Z元素在元素周期表的各元素中电负性仅小于氟,则Z为O元素;M元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为
,则Y为N元素;Z元素在元素周期表的各元素中电负性仅小于氟,则Z为O元素;M元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为![]() ,则M为Cl;第四周期过渡元素,其价电子层各能级处于半充满状态,应为Cr元素,价层电子排布式为
,则M为Cl;第四周期过渡元素,其价电子层各能级处于半充满状态,应为Cr元素,价层电子排布式为![]() 。
。
(1)M为Cl,原子核外电子排布为![]() 共有17种不同运动状态的电子,有5种不同能级的电子;
共有17种不同运动状态的电子,有5种不同能级的电子;
(2)同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,因为N原子的2p能级电子为半充满,为较稳定的结构,则N的第一电能较大;
(3)根据题意知Y的单质为N2,其中氮氮之间存在1个![]() 键和2个
键和2个![]() 键,因此
键,因此![]() 键与
键与![]() 键数目之比为1:2。
键数目之比为1:2。![]() 中心氧原子有6个价电子,两个Cl分别提供一个电子,所以中心原子价电子对数
中心氧原子有6个价电子,两个Cl分别提供一个电子,所以中心原子价电子对数![]() ,中心O原子杂化为
,中心O原子杂化为![]() 杂化,空间构型为V型;
杂化,空间构型为V型;


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
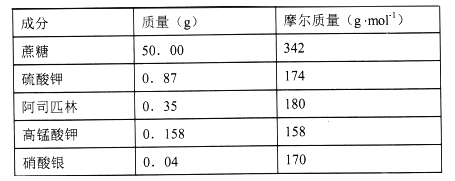
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是_________。
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银 E.水
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__mol/L。
(3)配制上述500mL“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、量筒、胶头滴管、_____。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作会使配制结果浓度偏低的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液时未洗涤烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E.加水时超过刻度线,用胶头滴管吸出
F.未冷却至室温就注入容量瓶定容
(5)“花卉保鲜剂”中高锰酸钾的主要作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
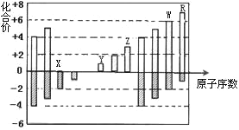
A. 原子半径:Z>Y>X
B. 气态氢化物的还原性: R < W
C. WX3和水反应形成的化合物是共价化合物
D. 含Z的两种盐溶液反应的离子方程式是Z3++ZO2-+H2O=2Z(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)实验步骤①的目的是___________________________________________。
(2)写出实验步骤②中的化学方程式__________________________________________。
(3)补全实验步骤③的操作名称_________________________。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是_______________________________。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你______(填“是”或“否”)同意乙的观点
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
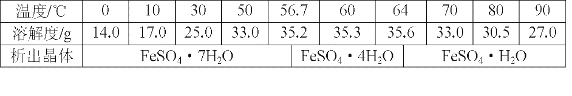
请根据表中数据画出硫酸亚铁的溶解度曲线示意图。__
(7)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________________。
(8)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100 mL用c mol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com