
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,![]() 比
比![]() 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为
少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为![]() ,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中
,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中![]() 与
与![]() 离子数之比为2:1。请回答下列问题:
离子数之比为2:1。请回答下列问题:
(1)![]() 形成的晶体属于______
形成的晶体属于______![]() 填写离子、分子、原子
填写离子、分子、原子![]() 晶体.
晶体.
(2)![]() 的电子排布式为______,在
的电子排布式为______,在![]() 分子中C元素原子的原子轨道发生的是______杂化,
分子中C元素原子的原子轨道发生的是______杂化,![]() 分子的VSEPR模型为______.
分子的VSEPR模型为______.
(3)![]() 的氢化物在水中的溶解度特别大,原因______
的氢化物在水中的溶解度特别大,原因______
(4)![]() 元素与同周期相邻元素的第一电离能由大到小的关系是:______
元素与同周期相邻元素的第一电离能由大到小的关系是:______![]() 用元素符号表示
用元素符号表示![]() ;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
(5)已知下列数据:
![]()
![]()
由![]() 和
和![]() 反应生成CuO的热化学方程式是______.
反应生成CuO的热化学方程式是______.
【答案】离子 ![]()
![]() 四面体形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水
四面体形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水 ![]()
![]()
![]()
【解析】
B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;![]() 比
比![]() 少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为
少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为![]() ,是第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第VIA族元素,最高价氧化物中含D的质量分数为
,是第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第VIA族元素,最高价氧化物中含D的质量分数为![]() ,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;
,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;![]() 是
是![]() 离子,
离子,![]() 离子是
离子是![]() 离子,R是由
离子,R是由![]() 离子与
离子与![]() 离子以2:1形成的离子化合物,R是硫化钠,以此解答本题。
离子以2:1形成的离子化合物,R是硫化钠,以此解答本题。
(1)由上述分析可知:R是硫化钠,是由A、D两元素形成的离子化合物,属于离子晶体,故答案为:离子;
(2)由C为N元素,![]() 核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:
核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:![]() ,
,![]() 分子为
分子为![]() 分子,N原子有一对孤对电子,与Cl原子成3个
分子,N原子有一对孤对电子,与Cl原子成3个![]() 键,N原子发生
键,N原子发生![]() 杂化,所以
杂化,所以![]() 分的VSEPR模型为四面体形, 故答案为:
分的VSEPR模型为四面体形, 故答案为:![]() ;
;![]() ;四面体形;
;四面体形;
![]() 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;故答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;故答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
![]() 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:![]() ;
;
同一周期元素中,元素的电负性随着原子序数的增大而增大,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在![]() 反应中,
反应中,![]() 的氧化性大于
的氧化性大于![]() 的氧化性, 故答案为:
的氧化性, 故答案为:![]() ;
;![]() ;
;
![]() 已知:
已知:![]()
![]()
根据盖斯定律,![]() 得:
得:![]() ,
,
故答案为:![]() .
.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
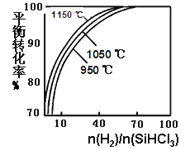
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3 和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
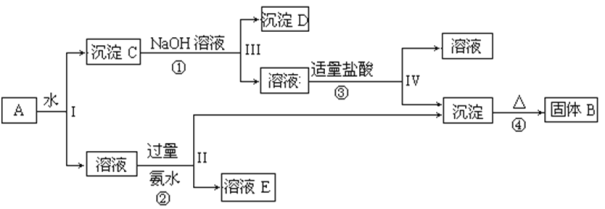
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、C、D所含物质的化学式固体B _______; 沉淀C ________ ; 沉淀D ________;
(3)写出①、②、③的离子方程式和④的化学方程式:
①__________________________________________
②_________________________________________
③_________________________________________
④ ________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
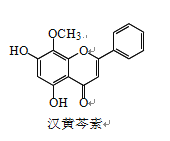
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:H2OH++OH-。请回答下列有关问题:
(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有_________。
A.加热至100℃ B.加入 NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积为_____,此温度____25℃(选填“大于”“小于”或“等于”),理由是________。
(3)在25℃时,将pH=a的NaOH溶液VaL与pH=b的HCl溶液VbL混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va:Vb=__________。
②若所得溶液呈中性,且Va:Vb=10:1,则a+b=__________。
③若所得混合溶液的pH=10,且a=12,b=2,则 Va: Vb=___________。
④若将pH=12的NaOH溶液VaL与VbL水混合后所得溶液的pH=10,则Va:Vb=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物分子中所有的原子不可能都处于同一平面的是(
A.CF2=CF2B.HC≡CHC.C6H5—CH=CH—CHOD.CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝热反应2Al+Fe2O3![]() 2Fe+Al2O3的说法正确的是( )
2Fe+Al2O3的说法正确的是( )
A.Al发生氧化反应B.Fe2O3被氧化
C.Fe是还原剂D.Al2O3是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com