
【题目】我国是全钒液流电池最大生产国,产品出口美、欧、日等发达国家,市 场占有率全球第一。全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O![]() VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
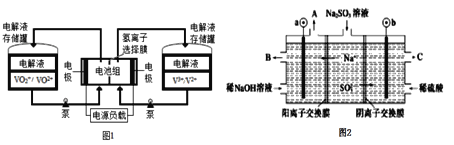
A.电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B.电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
C.电池放电时,负极电解液的pH升高
D.若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3阴极区变化的质量为4.5g
【答案】B
【解析】
图2中Na+移向a极,a是阴极,阴极电极反应: 4H++4e-=2H2↑,b是阳极,电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,所以a极与电池负极相连,图1中电池放电时,V3+→V2+,右边是正极,左边为负极,原电池中阳离子向正极移动,据此分析解答。
A.Na+移向a极,a是阴极,所以a极与电池负极相连,电池放电时,V3+→V2+,右边是正极,所以图1中H+从电池左边移向右边,故A错误;
B.SO32-移向b极,b是阳极,电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,故B正确;
C.电池放电时,负极失电子发生氧化反应,电极反应式为VO2+-e-+ H2O= VO2++ 2H+,根据电极反应可知,产生氢离子,负极电解液的pH降低,故C错误;
D.电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,消耗12.6gNa2SO3的物质的量为![]() =0.1mol,转移0.2mol电子,有0.2molNa+移入阴极区,根据阴极电极反应: 4H++4e-=2H2↑,阴极生成0.1mol氢气,所以变化的质量为0.2mol×23g/mol-0.2g=4.4g,故D错误;
=0.1mol,转移0.2mol电子,有0.2molNa+移入阴极区,根据阴极电极反应: 4H++4e-=2H2↑,阴极生成0.1mol氢气,所以变化的质量为0.2mol×23g/mol-0.2g=4.4g,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请你回答下列问题:
(1)甲同学的实验中有关的化学方程式为___________。
(2)甲同学设计的实验____(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是____。
①使溴水褪色的反应,未必是加成反应
②使溴水褪色的反应,就是加成反应
③使溴水褪色的物质,未必是乙烯
④使溴水褪色的物质,就是乙烯
(3)乙同学推测此乙烯中必定含有的一种杂质气体是____,它与溴水反应的化学方程式是___________。在验证过程中必须全部除去杂质气体,除去该杂质的试剂可选用_______。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取的方法有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有25mLpH=12的一元碱MOH溶液的绝热容器中滴加0.05mol·L-1H2SO4溶液,加入H2SO4溶液的体积(V)与所得混合溶液温度(T)的关系如图所示。下列说法正确的是( )
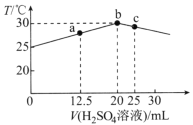
A.应选用酚酞作指示剂
B.a点溶液中存在:c(MOH)+c(M+)<4c(SO![]() )
)
C.水的电离程度:a<b<c
D.b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】囧烷(G)是一种重要的烃,一种合成囧烷的路线如图所示:
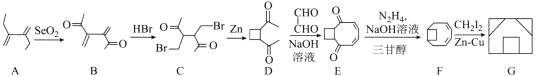
已知: +R2—CHO
+R2—CHO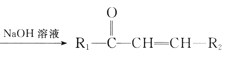 +H2O。
+H2O。
请回答下列问题:
(1)A的化学名称为___;G的分子式为__。
(2)B→C的反应类型为___;C中所含官能团的名称为__。
(3)D→E的化学方程式为___。
(4)同时满足下列条件的B的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为___。
①属于芳香族化合物且苯环上连有3个取代基。
②与FeC13溶液发生显色反应。
(5)参照上述合成路线和信息,以![]() 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A是一种酯,分子式为C4H8O2,A可以由醇B与酸C发生酯化反应得到,B氧化可得C。则:
①写出下列化合物的结构简式:
B______________________,C________________________________________。
②写出A在碱性条件下水解的化学方程式:________________________________________。
③A中混有少量的B和C,除去C选用的试剂是________,分离方法是_______________。
④B和C的酯化反应和A的水解反应中都用到硫酸,其作用分别是________(填字母)。
a、催化剂、脱水剂;催化剂
b、催化剂、吸水剂;催化剂
c、都作催化剂
d、吸水剂;催化剂
(2)在酸性条件下,CH3CO18OC2H5的水解产物是________。
(3)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法不正确的是________(填字母)。
a、一定条件下能与甘油发生酯化反应
b、能与NaOH溶液反应
c、能使酸性KMnO4溶液褪色
d、1 mol亚油酸最多能与4 mol Br2发生加成反应
(4)有机物![]() 是一种酯。参照乙酸乙酯水解中化学键变化的特点分析判断,这种酯在酸性条件下水解生成3种新物质,结构简式分别为____________________、____________________________________________________、________。
是一种酯。参照乙酸乙酯水解中化学键变化的特点分析判断,这种酯在酸性条件下水解生成3种新物质,结构简式分别为____________________、____________________________________________________、________。
(5)有机物W(![]() )常用于合成维生素类药物。该有机物的分子式为________,其分子中所含官能团的名称为______________,水溶液中l mol W可与______ mol NaOH完全反应,分子中含有______种不同化学环境的氢原子。
)常用于合成维生素类药物。该有机物的分子式为________,其分子中所含官能团的名称为______________,水溶液中l mol W可与______ mol NaOH完全反应,分子中含有______种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:

(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为____________________________________。
4乙,则甲的分子式为________,乙的结构简式为____________________________________。
(2)B装置中的实验现象可能是________,写出反应的化学方程式:__________,其反应类型是________。
(3)C装置中可观察到的现象是____________,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_____(填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由: __________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是________。
A.气体通入水中 B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒
D.乙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.1000 mol·L1 NaOH 溶液分别滴定 20.00 mL 0.1000 mol·L1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
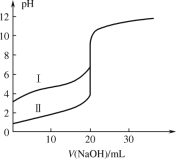
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH) = 10.00 mL 时,醋酸溶液中c(CH3COOH)<c(CH3COO)
C.pH = 7 时,滴定盐酸消耗的 NaOH 溶液体积小于滴定醋酸消耗的 NaOH 溶液体积
D.V(NaOH) = 20.00 mL 时,两溶液中 c(CH3COO)=c(Cl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com