
����Ŀ�����÷�Ӧ6NO2+8NH3=7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ������˵������ȷ����

A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ2NH3-6e- =N2+6H+
D. ����2.24LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.4mol
���𰸡�C
��������
�ɷ�Ӧ6NO2+8NH3�T7N2+12H2O��֪����Ӧ��NO2Ϊ��������NH3Ϊ��ԭ������AΪ������BΪ��������������������Ӧ������������ԭ��Ӧ����ϵ������Һ�ʼ��Խ����⡣
�ɷ�Ӧ6NO2+8NH3�T7N2+12H2O��֪����Ӧ��NO2Ϊ��������NH3Ϊ��ԭ������AΪ������BΪ������
A��BΪ������AΪ����������������������������ѡ��A��ȷ��
B������ʧȥ�������ɵ����������ӣ��ڼ��Ե������Һ�У����������ƶ��������������ӽ��Ϊˮ�����Ը����ӽ���ĤӦ��������������ͨ���������������ӽ���Ĥ��ѡ��B��ȷ��
C���������Һ�ʼ��ԣ���AΪ�������缫����ʽΪ2NH3-6e-+6OH-=N2+3H2O��ѡ��C����
D������2.24L NO2����״������0.1mol ������ʱ��ת�Ƶ���Ϊ0.1mol����4-0��=0.4mol��ѡ��D��ȷ��
��ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��Ԫ����ָԪ�����ڱ���ԭ������Ϊ57��71��15����ϵԪ�أ��Լ�����ϵԪ�ػ�ѧ�������Ƶ���(Sc)����(Y)����17��Ԫ�ء�ϡ��������ҵά�����������ƣ�����ѳ�Ϊ������Ҫ��ս����Դ��
��1����ϵԪ��λ��Ԫ�����ڱ���_______�壬��ϵԪ��λ�����ڱ���______����
��2����(Sc)Ϊ21��Ԫ�أ����̬ԭ��M�ܲ������Ϊ_______����̬��(Dy)ԭ�ӵĵ����Ų�ʽΪ[Xe]4f106s2��һ����̬��ԭ��������δ�ɶԵ�����Ϊ______��
��3��ϡ��Ԫ������Ļ��ϼ�Ϊ+3�ۣ���Ҳ����������+4�ۡ�������±��еĵ��������ݣ��жϱ����������+4�۵�Ԫ����___��
����ϡ��Ԫ�صĵ�����(��λ��kJ��mol��1)��

��4��Sm(��)�ĵ�����1��2-��������ɷ�����ӦSm+ICH2CH2I��SmI2+CH2=CH2��ICH2CH2I��̼ԭ�ӵ��ӻ��������Ϊ_____��1 mol CH2=CH2�к��е�������ĿΪ____�������£�1��2-��������ΪҺ�������Ϊ���壬����Ҫԭ����_____��
��5��PrO2(��������)�ľ���ṹ��CaF2���ƣ�������Pr(��)ԭ��λ�����ĺͶ��㣬��PrO2(��������)�ľ�������_____����ԭ�ӡ�
��6��Ce(��)����Ϊ�����������壬�����ԭ������Ϊ140���侧������Ϊ��=516pm��������Ce(��)ԭ�ӵ���λ��Ϊ______����ʽ��ʾCe(��)���ʵ��ܶ�Ϊ______g��cm��3(���ؼ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦCO��g��+H2O��g��![]() CO 2��g��+ H 2��g�� ��H��0����������������������
CO 2��g��+ H 2��g�� ��H��0����������������������
A. ����������ı��˷�Ӧ��;������Ӧ����HҲ��֮�ı�
B. �ı�ѹǿ��ƽ�ⲻ�����ƶ�����Ӧ�ų�����������
C. �����¶ȣ���Ӧ���ʼӿ죬��Ӧ�ų�����������
D. ����ԭ����н��У���Ӧ�ų�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������⣺
(1)��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������
CO(g)��H2O(g) ![]() CO2(g)��H2(g) ��H����41 kJ/mol
CO2(g)��H2(g) ��H����41 kJ/mol
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol��д��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ��_______________________________________��
(2)���Ŵ�����Ⱦ���������أ������ܼ�����������ȫ�����������ŷţ��о�NO x��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣�û���̿��ԭ��������������йط�ӦΪ:C(s)��2NO(g)![]() N2(g)��CO2(g)��ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2(g)��ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/mol��L��1 ʱ��/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
����ӷ�Ӧ��ʼ��20miʱ����NO��ʾ��ƽ����Ӧ����= ________�����¶��¸÷�Ӧ��ƽ�ⳣ��K��____��������λС����
��30min�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������_____��дһ�����ɣ���
��������������˵��������Ӧ�Ѵ�ƽ�����__________��
A�������������ƽ��Ħ���������ֲ���
B��2v(NO)��=v(N2)��
C�������������ѹǿ���ֲ���
D����λʱ��������nmolCO2��ͬʱ����2nmolNO
(3)����Fe2+��Fe3+�Ĵ����ã������½�SO2ת��ΪSO42���� ��ʵ��SO2�Ĵ������ܷ�ӦΪ2SO2+O2+2H2O��2H2SO4������֪����SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ_______________
(4)��ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ�

��AΪSO2��BΪO2��CΪH2SO4������ӦʽΪ_______________________________������ܷ�ӦʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵���������
A. PM2.5��PM10���ǿ�������ָ��(AQI)����Ҫָ��
B. ����β���е�NO2��CO2���Ǵ�����Ⱦ
C. ����ϩ�;�����ϩ�������Ӷ��ܲ�����ɫ��Ⱦ
D. ��N��P�Ĵ�����ˮ�����ŷŶ��ܵ���ˮ�帻Ӫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I ������þ���ʻ��ã������������ʷ�Ӧ��ijУ����С�����þ���ڶ�����̼��ȼ�գ��Ʋ�MgҲ����NO2ȼ�գ����ܲ���ΪMgO��N2��Mg3N2��ͨ����ͼ��ʾʵ��װ������֤��Ӧ����г�װ��ʡ�ԣ������������ظ�ʹ�ã�����֪��NO2�����ܱ�NaOH���գ�Mg3N2������ˮ��Ӧ��
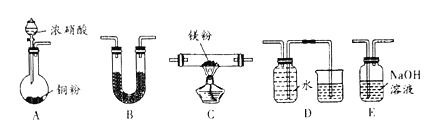
��1��ʵ���У�װ������������˳��ΪA _________������ĸ��ţ���װ��B ��������______��
��2����������N2��ʵ��װ��Ϊ__________������ĸ��ţ���
��3�����ʵ��֤���������д���Mg3N2 ____________��
��ҵ������þ��Ϊԭ�ϣ���Ҫ�ɷ�ΪMgCO3������SiO2��FeCO3�����ʣ��Ʊ���������þ��
��4�����ݷ�Ӧ����Ҫ���ȳ�ȥFeCO3������������������ķ��������м���H2O2ʱ��������Ӧ�����ӷ���ʽΪ__________��
��5����֪����һ��������CO(NH2)2����H2O��Ӧ����CO2��һ��������̺��ڣ���������ɺ��ټ���CO(NH2)2 ��ʼ����Mg2+���ù����з�����������Ҫ��ӦΪ���û�ѧ����ʽ�����ӷ�Ӧ����ʽ��ʾ��___________��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѧ���ݣ��ش��������⣺
��ijͬѧ����Ӱ����������Ը��������Һ��Ӧ�������ص��о������������Ը�����صķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4��K2SO4+2MnSO4+10CO2��+8H2O�������£���֧�Թֱܷ��Ţٺ͢ڣ�ʵ���������£�
ʵ����� | �� | �� |
�����Լ� | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ һ���ƶ������MnSO4���� |
��ɫʱ��/s | 116 | 6 |
�Թܢ���KMnO4��Һ��ɫ�����ʿ�ʼʮ�ֻ�����һ��ʱ���ͻȻ�ӿ졣
��ش�
(1)��ʵ�������___________________________________________________________��
(2)ʵ���ѡ��MnSO4���������MnCl2�����ԭ����____________________________��
(3)��ͬѧΪʹʵ��������ܣ����Թܢ�����������ʵ�飬��Ԥ����ɫʱ��ԼΪ_____��
ʵ����� | �� |
�����Լ� | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ һ���ƶ������Na2SO4���� |
��ɫʱ��/s |
�ζ�����һ����Ҫ�Ķ�������������Ӧ�÷�Χ�ܹ㡣ij���г������۵�һ��ʳ�þ����ΰ�װ���������²���˵����
��Ʒ�ȼ� | һ�� |
���� | ʳ�Ρ������(KIO3)������� |
�⺬��(��I��) | 20��50 mg��kg��1 |
��֪��IO3����5I����6H�� = 3I2��3H2O��I2��2S2O32- = 2I����S4O62-ijѧ����ⶨʳ�þ����εĵ⺬�����䲽��Ϊ
a��ȷ��ȡW gʳ�Σ�����������ˮʹ����ȫ�ܽ�
b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ
c������ָʾ������μ������ʵ���Ũ��Ϊ2.0��10/span>��3 mol��L��1��Na2S2O3��Һ10.0 mL��ǡ�÷�Ӧ��ȫ
(4)c�м����ָʾ����ѡ��_________��ǡ����ȫ��Ӧʱ��������_______________��
(5)������b�ڿ�������ʱ������������ղⶨ�IJⶨʳ�þ������еĵĵ⺬����__________(����ƫ��������ƫ��������û��Ӱ����)��
(6)��������ʵ��Ͱ�װ˵�����������ʳ�þ����εĵ⺬����(�Ժ�W�Ĵ���ʽ��ʾ)________mg��kg��1(������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=-lgKa��25��ʱ��H2A��pKa1=1.85��Pka2=7.19����0.1 mol/L NaOH��Һ�ζ�20 mL 0.1 mol/L H2A��Һ�ĵζ�������ͼ��ʾ�������ϵ�����ΪpH��������˵������ȷ���ǣ� ��
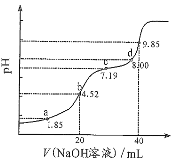
A. a��������Һ�У�2n(H2A)+n(A2-)=0.002mol
B. b��������Һ�У�c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c��������Һ�У�c(Na+)<3c(HA-)
D. d��������Һ�У�c(Na+)>c(A2-)>c(HA-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�ش��������⣺
(1)��Ӧ��ġ�H2=_________________��
(2)��Ӧ���ܹ��Է����е�������_______________(�����ϵ��¶��� ���ϸ��¶��������κ��¶��� )��
(3)���£������ܱ������У����ڷ�Ӧ������˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����______��
A�����������ܶȲ��ٱ仯 B����������ƽ����Է����������ٱ仯
C��CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1
D���״��İٷֺ������ٱ仯
(4)���ڷ�Ӧ��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����__________��

A�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��M1
B���¶ȵ���250 ��ʱ�����¶����״��IJ�������
C��M ��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
(5)��֪����������20���µ�Ksp���£��Իش��������⣺
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 1.8��10-10 | 5.4��10-13 | 8.3��10-17 | 6.3��10-50 | 2.0��10-12 |
��20��ʱ�������������α�����Һ�У�Ag+���ʵ���Ũ�ɴ�С��˳����____________��
����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱc(Br-)/c(Cl-)=________________��
�� �ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����____��
A.KBr B��KI C��K2S D��K2CrO4
(6)��֪25��ʱKsp[Mg(OH)2]=5.6��10-12��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Al(OH)3]=1.1��10-33��
����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��AlCl3��CuCl2�����Һ����μ��백ˮ��������______________����(�ѧʽ)��
����Һ��ij�������ʵ���Ũ�ȵ���1.0��10-5 mol��L-1ʱ������Ϊ�ѳ�����ȫ������һ��Ũ�ȵ�AlCl3��FeCl3�Ļ����Һ����μ��백ˮ����Fe3+�պ���ȫ����ʱ���ⶨc(Al3+)=0.2mol��L-1����ʱ���ó�����___________(������������������������)Al(OH)3������д��������̡�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com