
【题目】A、B、C、D、E是中学化学中常见的四种短周期元素,有关位置及信息如下:
A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F单质是日常生活中用量最大的金属,易被腐蚀或损坏。
| E | A | B | ||
C |
| D |
请回答下列问题:
![]() 元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
![]() 、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸
、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸![]() 蒸馏水除外
蒸馏水除外![]() 有 ______ 。
有 ______ 。
![]() 、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
![]() 与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
![]() 和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
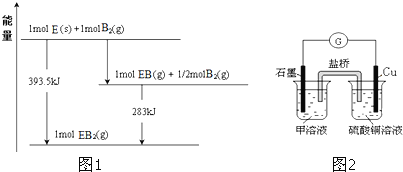
![]() 已知一定量的E单质能在
已知一定量的E单质能在![]()
![]() 中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下
中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式 ______ 。
的热化学方程式 ______ 。
![]() 若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
【答案】![]() 氢氧化钠溶液、红色石蕊试纸,硝酸银溶液、稀硝酸 离子键和共价键 ①③④
氢氧化钠溶液、红色石蕊试纸,硝酸银溶液、稀硝酸 离子键和共价键 ①③④ ![]()
![]() ;
;![]() 黄色溶液慢慢变为浅绿色
黄色溶液慢慢变为浅绿色 ![]()
【解析】
A、B、C、D、E是中学化学中常见的四种短周期元素,A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,该离子化合物为铵盐,则A为N元素;C单质一般保存在煤油中,则C为Na;F单质是日常生活中用量最大的金属,易被腐蚀或损坏,则F为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素;
![]() 为N元素,其氢化物
为N元素,其氢化物![]() 水溶液中一水合氨发生电离:
水溶液中一水合氨发生电离:![]() ,溶液呈碱性,能使酚酞变红,故答案为:
,溶液呈碱性,能使酚酞变红,故答案为:![]() ;
;
![]() 、D的氢化物相互反应,产生白色固体为
、D的氢化物相互反应,产生白色固体为![]() ,检验铵根离子用氢氧化钠和红色石蕊试纸,检验氯离子用稀硝酸和硝酸银;故答案为:氢氧化钠溶液、红色石蕊试纸,硝酸银溶液、稀硝酸;
,检验铵根离子用氢氧化钠和红色石蕊试纸,检验氯离子用稀硝酸和硝酸银;故答案为:氢氧化钠溶液、红色石蕊试纸,硝酸银溶液、稀硝酸;
![]() 、C组成的化合物
、C组成的化合物![]() 和
和![]() 反应可生成
反应可生成![]() ,
,![]() 中所含有的化学键为离子键和共价键;故答案为:离子键和共价键;
中所含有的化学键为离子键和共价键;故答案为:离子键和共价键;
![]() 与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比
与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比![]() :
:![]() :2,该分子为
:2,该分子为![]() ,该分子释放在空气中其化学作用可能引发的后果有:酸雨、光化学烟雾、破坏臭氧层,二氧化碳等为导致温室效应,故答案为:
,该分子释放在空气中其化学作用可能引发的后果有:酸雨、光化学烟雾、破坏臭氧层,二氧化碳等为导致温室效应,故答案为:![]() ;
;
![]() 和Na组成的一种离子化合物,能与水反应生成两种碱,该化合物为
和Na组成的一种离子化合物,能与水反应生成两种碱,该化合物为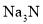 ,该反应的化学方程式是:
,该反应的化学方程式是:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由图可知,
由图可知,![]() 与
与![]() 反应得到
反应得到![]() 放出热量
放出热量![]() ,该反应热化学方程式为:
,该反应热化学方程式为:![]() 与
与![]() 反应得到
反应得到![]() 放出热量
放出热量![]() ,该反应热化学方程式为:
,该反应热化学方程式为:![]() 根据盖斯定律,
根据盖斯定律,![]() 得:
得:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为
若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为![]() ,两者反应的方程式为Cu+2FeCl3=CuCl2+2FeCl2,设计如图所示的原电池,正极上
,两者反应的方程式为Cu+2FeCl3=CuCl2+2FeCl2,设计如图所示的原电池,正极上![]() 黄色
黄色![]() 得电子生成
得电子生成![]() 浅绿色
浅绿色![]() ,则正极出现的现象是黄色溶液慢慢变为浅绿色,负极反应式为:
,则正极出现的现象是黄色溶液慢慢变为浅绿色,负极反应式为:![]() ,故答案为:黄色溶液慢慢变为浅绿色;
,故答案为:黄色溶液慢慢变为浅绿色;![]() 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )

A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: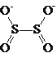 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
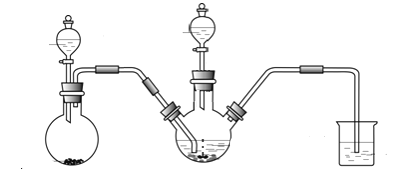
(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.弱电解质溶液中至少存在两种共价化合物分子
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.![]() 属于非电解质,但其水溶液能够导电
属于非电解质,但其水溶液能够导电
D.同位素单质混合在一起一般是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
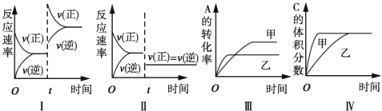
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A.含硫物种B表示HS-
B.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C.X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值
D.NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-===CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com