


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
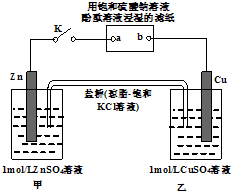
| A��������Zn��a��b��Cu·������ |
| B��Ƭ�̺�׳������������Ũ������ |
| C��Cu�缫�Ϸ�����ԭ��Ӧ |
| D��Ƭ�̺�ɹ۲쵽��ֽb����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����NaAlO2��Һ��ͨ�����CO2��AlO2-+CO2+2H2O�TAl��OH��3��+HCO3- |
| B��Cl2��ˮ�ķ�Ӧ��Cl2+H2O�T2H++Cl-+ClO- |
| C��������Һ��ˮ���е�CaCO3��Ӧ��CaCO3+2H+�TCa2++H2O+CO2�� |
| D��FeCl3��Һ��Cu�ķ�Ӧ��Cu+Fe3+�TCu2++Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��DΪԭ���������������ǰ������Ԫ�أ�Ԫ��Aԭ���������������ڲ��3����Ԫ��B��̬ԭ�Ӻ�����2��δ�ɶԵ��ӣ�Ԫ��C����ۺ���ͼ۴����͵���0��Ԫ��Dλ�����ڱ���B�壮
A��B��C��DΪԭ���������������ǰ������Ԫ�أ�Ԫ��Aԭ���������������ڲ��3����Ԫ��B��̬ԭ�Ӻ�����2��δ�ɶԵ��ӣ�Ԫ��C����ۺ���ͼ۴����͵���0��Ԫ��Dλ�����ڱ���B�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
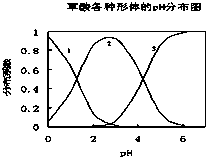 ���ᣨH2C2O4����һ��������ˮ�Ķ�Ԫ��ǿ�ᣬ��ˮ�����Ĵ�����̬��H2C2O4��HC2O4-��C2O42-������̬�ķֲ�ϵ����Ũ�ȷ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��
���ᣨH2C2O4����һ��������ˮ�Ķ�Ԫ��ǿ�ᣬ��ˮ�����Ĵ�����̬��H2C2O4��HC2O4-��C2O42-������̬�ķֲ�ϵ����Ũ�ȷ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��| c(Na+) |
| c(C2O42-) |
| c(Na+) | ||
c(C2
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ֵ�������� | H2O | NH3?H2O��һˮ�ϰ��� | HClO�������ᣩ |
| ������������� | H+��OH- | NH4+��OH- | H+��ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com