


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液查看答案和解析>>
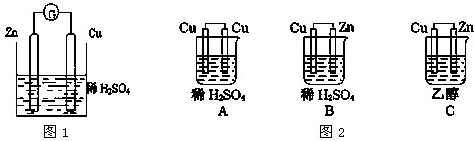
科目:高中化学 来源: 题型:
查看答案和解析>>
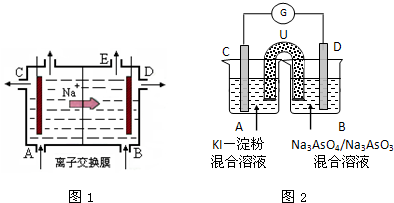
科目:高中化学 来源: 题型:
查看答案和解析>>
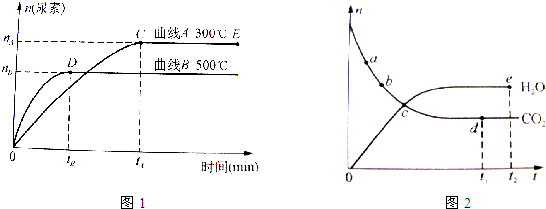
科目:高中化学 来源: 题型:
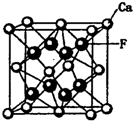 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A<B<C |
| B、B<C<A |
| C、B<A<C |
| D、C<A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把过量碳酸氢钠溶液加入到氢氧化钡溶液中:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7(常温时):Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、标况下112mL Cl2通入10mL 1mol/L的FeBr2溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com