


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
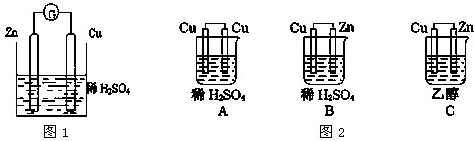
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与氯气反应生成氯化钠后,稳定性增强,体系的能量降低 |
| B、物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C、氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很不活泼 |
| D、需加热才能发生的反应一定是吸收能量的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 |
| 过量乙 |
| 丙 |
| A、BaCl2、H2SO4、MgCl2 |
| B、CaCl2、HNO3、BaCl2 |
| C、CaCl2、HNO3、NaCl |
| D、BaCl2、HCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
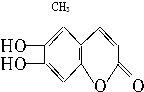 中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )
中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )| A、3 mol,2 mol |
| B、3 mol,4 mol |
| C、2 mol,3 mol |
| D、4 mol,4 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com