
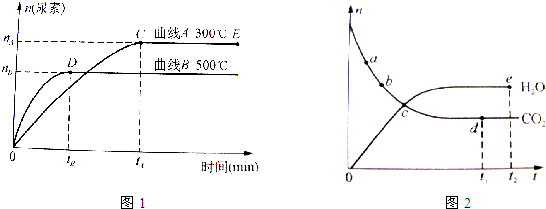
| c(H2O) |
| c(CO2)c2(NH3) |
| c(H2O) |
| c(CO2)c2(NH3) |


科目:高中化学 来源: 题型:
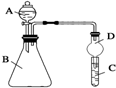 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
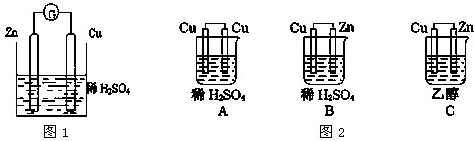
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与氯气反应生成氯化钠后,稳定性增强,体系的能量降低 |
| B、物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C、氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很不活泼 |
| D、需加热才能发生的反应一定是吸收能量的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂后H2和O2反应生成水 |
| B、棕红色NO2加压后颜色先变深后变浅 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com