
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

【答案】 第3周期VIA族 O2- BeO+2OH-=BeO22-+H2O 极性共价键和非极性共价键 正 O2+2e-+2H2O=H2O2+2OH-。
【解析】本题考查元素周期表和元素周期律的应用,根据主族元素最外层电子数等于族序数,因为六种元素为短周期元素, X和M主要化合价为+2价,即位于IIA族,同主族从上到下,原子半径增大,即M为Be,X为Mg,Z和Q的最低价态为-2价,说明这两种元素位于VIA族,同主族从上到下,原子半径增大,即Q为O,Z为S,R为+1价,原子半径最小,因此推出R为H,Y的化合价为+3价,推出Y为IIIA族元素,根据原子半径大小,推出Y为Al,(1)Z为S,位于第三周期VIA族;(2)形成的简单离子分别为Mg2+、Al3+、O2-,核外电子排布相同,半径随着原子序数的递增而减小,即O2->Mg2+>Al3+,因此离子半径最大的是O2-;(3)根据所给信息,Be与Al为对角线,因此BeO具有两性,与强碱反应的离子反应方程式为BeO+2OH-=BeO22-+H2O;(4)①H和O形成1:1的化合物,即为H2O2,其结构式为H-O-O-H,含有共价键类型为极性共价键和非极性共价键;②利用信息,空气中氧气还原得到H2O2,因此氧气得到电子,即通空气一极为阴极,b为负极,a为正极,阴极反应式为O2+2H2O+2e-=H2O2+2OH-。


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.生石灰、白磷、冰水混合物
B.烧碱、液氧、碘酒
C.干冰、铁、氯化氢
D.纯碱、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图


写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:

①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是![]()
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中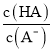 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka=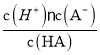 =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中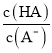 =
=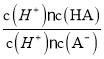 =
=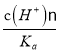 =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
【题型】单选题
【结束】
24
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:

(1)当电极a为A1、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:_____________。
(2)当电极a为Fe、电极b为Cu、电解质溶液为浓硝酸时,该装置_______(填“能”或“不能”)形成原电池,若不能,请说明理由________________________;若能,请写出该电池负极的电极反应方程式____________________。
(3)设计一燃料电池,以电极a为正极,电极b为负极,CH4为燃料,采用酸性溶液为电解液;则CH4应通入_______极(填a或b,下同),电子从_______极流出。电池的负极反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别乙醇、苯和CCl4最简单的方法是( )
A. 加酸性高锰酸钾溶液后振荡,静置
B. 与乙酸在有浓硫酸存在的条件下加热
C. 加蒸馏水后震荡静置
D. 加硝酸银溶液后振荡静置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如图装置制取乙烯,反应原理为 CH3CH2OH![]() CH2═CH2↑+H2O,某化学学习小组通过该原理制取乙烯并对其性质进行验证。
CH2═CH2↑+H2O,某化学学习小组通过该原理制取乙烯并对其性质进行验证。

(1)在制取时,常常需要在烧瓶中加入碎瓷片,目的是____________。
(2)要检验生成的物质,应该首先检验________,常选用的药品为_______________。
(3)制取时,关键要控制好温度。
①温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。为了除去除水蒸气外的杂质气体,常用装有下列试剂的洗气瓶进行洗气,则应选用的试剂是______。
A.酸性KMnO4溶液 B.浓硫酸 C.NaOH溶液 D.溴水
②制取时温度过低,在1400C时主要发生分子间取代反应生成乙醚(CH3CH2OCH2CH3),试写出其反应方程式___________。
(4)将净化后的气体先通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,并有新的无色无味气体产生,该气体可参与大气循环,发生反应的离子方程式为_____。然后将气体通入溴水,溴水褪色,并有油状物质生成。
(5)乙烯的某种同系物的相对分子质量为乙烯的3倍,其同分异构体总数为_____。将其与氢气加成,得到的烷烃再与氯气发生取代反应,其一氯取代产物为三种的烷烃的结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com