
【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
【答案】C
【解析】A、实验1中,开始通入20.0mol的CO和20.0molH2S,建立的平衡,与开始通入10.0mol的CO和10.0molH2S,建立的平衡互为等效平衡,通入20.0mol的CO和20.0molH2S,达到平衡, CO物质的量为(20-20×3/10)mol=14mol,温度由150℃升高到400℃,CO的物质的量由14mol→16mol,升高温度,平衡向逆反应反应方向移动,即正反应是放热反应,故A错误;B、实验1中消耗CO的物质的量为(10-7.0)mol=3mol,即CO的转化率为3/10×100%=30%,故B错误;
C、 CO(g)+H2S(g) ![]() COS(g)+H2(g)
COS(g)+H2(g)
起始:10 10 0 0
变化:3 3 3 3
平衡:7 7 3 3 ,此温度下,K=![]() ,实验2中浓度商Qc=
,实验2中浓度商Qc=![]() <K,说明反应正向移动,即a<7.0,故C正确;D、平衡常数只受温度的影响,因此再充入1.0molH2,平衡逆向移动,但化学平衡常数不变,故D错误。
<K,说明反应正向移动,即a<7.0,故C正确;D、平衡常数只受温度的影响,因此再充入1.0molH2,平衡逆向移动,但化学平衡常数不变,故D错误。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】室温时,下列溶液混合后,pH大于7的是
A. 0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B. 0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C. pH=3的硫酸和pH=11的氨水等体积混合
D. pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是重要的一元酸,在有机和无机反应中都有应用。现有25 ℃时,pH=3的醋酸。请回答以下问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中![]() ________(填“增大”“减小”或“不变”)。
________(填“增大”“减小”或“不变”)。
(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________(填“>”“<”或“=”)7,用离子方程式表示其原因_____________________________________。
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___________________________________________。
(4)若向醋酸中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
(5)若向醋酸中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中c(CH3COO-)-C(Na+)=________mol/L(填写准确数据)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5mL 0.Imol.L-1的KI溶液于试管,滴加0.Imol.L-1的FeCl3溶液5—6滴,振荡;
探究活动二:在上述试管中加入2mL CC14,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0. Imol.L-1的KSCN溶液5—6滴,振荡。
(1)写出探究活动一中反应的离子方程式____。
(2)探究活动二的实验现象为____。
A.溶液分层,上层呈紫色
B.溶液分层,下层呈紫色
C.溶液分层,均为无色
(3)在探究活动三中,可以证明该化学反应有一定的限度的实验现象是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
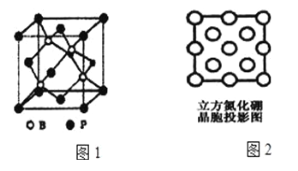
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下,下列叙述正确的是

A. 在浓硫酸加热条件下,化合物X可发生消去反应
B. 用FeCl3溶液可鉴别化合物X和Y
C. 化合物Y最多可与含6mol Br2的浓溴水发生反应
D. 化合物Y中不含有手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com