
【题目】Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
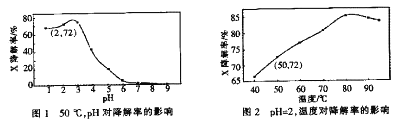
A. 50oC,PH在3~6之间,X降解率随pH增大而减小
B. pH=2,温度在40~80oC,X降解率随温度升高而增大
C. 无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80oC
D. pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H3PO2(次磷酸)是一种一元弱酸,H3PO2易溶于水且具有较强的还原性。
(1)H3PO2的结构式为____________________。
(2)H3PO2在水溶液中的电离方程式为_____________________。
(3)不断将新制的PH3通入搅拌的碘悬浮液中,直至碘的颜色消失,可得到次磷酸和氢碘酸,则该反应中氧化产物与还原产物的物质的量之比为__________________。
(4)酸性条件下,H3PO2可将Cr2O72-还原为Cr3-,其本身被氧化为磷酸,该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A. Ag+、K+、NO3-、C1- B. Mg2+、Na+、Cl-、SO42-
C. NH4+、Cu2+、OH-、Cl- D. H+、Na+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素R、X、Y、Z、T,R与T原子最外层电子数均是电子层数的2倍,Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:R<X<Y
C. T的最高价氧化物的水化物酸性比R的强
D. Y和Z分别与T、X组成的二元化合物的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是__________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)![]() CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应己经达到平衡状态的是_________________。
CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应己经达到平衡状态的是_________________。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25°C时,在20mL0.lmol/L 氢氟酸中加入VmL0.lmol/LNaOH 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②点时,溶液中的c(F- )=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0. lmol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2与足量C在体积可变的恒压密闭容器中发生反应:C(s)+CO2(g) ![]() 2CO(g),平衡时体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时体系中气体体积分数与温度的关系如下图所示:

下列说法不正确的是
A. 550℃时,v逆小于925℃时v逆
B. 650℃时,反应达平衡后,CO2的转化率为25%
C. 由图中数据分析可得,该反应为放热反应
D. T℃时,若向平衡体系内充入惰性气体,化学平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在水溶液中能大量共存的是( )
A.Ba2+、Cl-、SO42-、Na+B.SO32-、CO32-、NH4+、H+
C.H+、K+、OH-、NO3-D.K+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
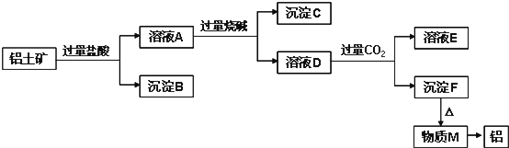
请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为____________________;
(2)由物质M制取铝的化学方程式为____________________;
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________;
(4)取一定量的沉淀C置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,所得溶液中Fe元素以_______存在,检验该离子的实验操作和现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com