
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是
A.原子半径由小到大的顺序为![]()
B.X的简单氢化物的热稳定性比W的强
C.化合物YX、![]() 、
、![]() 中化学键的类型相同
中化学键的类型相同
D.W的最高价氧化物对应水化物的酸性比Z的弱
【答案】B
【解析】
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,故X原子有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,处于第ⅡA族,原子序数大于O元素,故Y为Mg元素,Z的单质常作为半导体材料,Z是Si元素。
A项、同主族元素自上而下,原子半径依次增大,故原子半径O<S,同周期元素自左而右,原子半径依次减小,故原子半径Mg>Si>S,则原子半径由小到大的顺序为Mg>Si>S>O,即X<W<Z<Y,故A错误;
B项、元素非金属性越强,简单氢化物的热稳定性越强,氧元素和硫元素为同主族元素,氧元素的非金属性强于硫元素,则氧元素的简单氢化物的热稳定性比硫元素的强,故B正确;
C项、氧化镁为离子化合物只含有离子键,二氧化硅和三氧化硫为共价化合物只含有共价键,化学键的类型不同,故C错误;
D项、元素非金属性越强,最高价氧化物对应水化物的酸性越强,硫元素和硅元素为同周期元素,硫元素的非金属性强于硅元素,则硫元素的最高价氧化物对应水化物的酸性比Z元素的强,故D错误;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液
凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________________。
(2)本实验用到的基本仪器有__________________________________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会________(填“偏高”、“偏低”或“无影响”)。
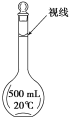
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会________; 加蒸馏水时不慎超过了刻度,会______。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应____________________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面, 应________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将1 L纯净的CH4在空气中完全燃烧,生成CO2和液态水,放出39.75 kJ热量,则燃烧的热化学方程式为( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-39.75 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890.4 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.4 kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=39.75 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
A. 该反应的平衡常数表达式为K=c(CO)/c(CO2)
B. 该反应的逆反应是放热反应
C. v正(CO2)=v逆(CO)时该反应达到平衡状态
D. c(CO2):c(CO)=1:1时该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下。下列说法正确的是
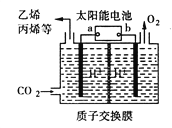
A. a电极为太阳能电池的正极
B. 产生丙烯的电极反应式为:3CO2+18H++18e-===CH3CH=CH2+6H2O
C. 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散
D. 太阳能电池的原理与原电池的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是

A. 光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B. 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-=V2+
D. 硅太阳能电池供电原理与该电池相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO +C![]() Pb +CO↑;PbO+CO
Pb +CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法错误的是( )
A.浮选法富集方铅矿的过程,属于物理变化
B.将lmolPbS冶炼成Pb,理论上至少需要12g碳
C.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D.焙烧过程中,每生成lmolPbO转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,将0.1 mol 氢气、2.8 g一氧化碳和0.05 mol 氮气的混合气体与足量氧气充分燃烧后,立即将所得混合气体通过足量的过氧化钠粉末,固体质量增加
A.2.8 gB.3.0 gC.7.2 gD.5.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com