
【题目】实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液
凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________________。
(2)本实验用到的基本仪器有__________________________________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会________(填“偏高”、“偏低”或“无影响”)。
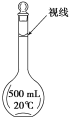
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会________; 加蒸馏水时不慎超过了刻度,会______。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应____________________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面, 应________________。
【答案】①②④③⑤ 天平、药匙、烧杯、玻璃棒、500 mL容量瓶、胶头滴管 偏高 偏低 偏低 宣告实验失败,从头重新做 宣告实验失败,从头重做
【解析】
(1)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择需要仪器;
(3)俯视刻度线导致溶液体积偏小,依据![]() 进行误差分析;
进行误差分析;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析;
进行误差分析;
(5)任何不当操作导致实验失败且无法补救的都必须重新配制。
(1)配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤和正确顺序为:①②④③⑤,故答案为:①②④③⑤;
(2)配制一定物质的量浓度的溶液的配制步骤:计算、称量、溶解、转移、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(3)图中同学俯视刻度线,导致溶液体积偏小,依据![]() 溶液浓度偏高;故答案为:偏高;
溶液浓度偏高;故答案为:偏高;
(4)没有进行洗涤操作,导致溶质的物质的量偏小,溶液浓度偏低;加蒸馏水时不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;故答案为:偏低;偏低;
(5)若实验过程中出现加蒸馏水时不慎超过了刻度,导致溶液失败且无法补救,所以应重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,导致溶液失败且无法补救,所以应重新配制;
故答案为:宣告实验失败,从头重新做;宣告实验失败,从头重新做。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
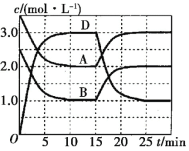
A.反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期主族元素 M、X、Y、Z、W,若它们的核外电子数用 n 表示,则有:n(M)+n(W)=n(X)+n(Z),2n(X)=n(Z)。含 0.9%YW 化合物的水溶液称为生理盐水,X、Y、Z 三元素组成两种化合物 A、B 的性质如图,下列说法正确的是( )
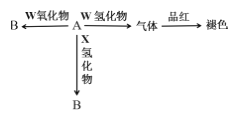
A.因为非金属性 X>Z,所以简单氢化物沸点 X>Z
B.MX2 与ZX2 是导致酸雨的“罪魁祸首”
C.Y 分别与 X、Z 构成的化合物溶于水均因水解显碱性
D.ZX2、WX2 能使红色布条褪色,褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。
CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。
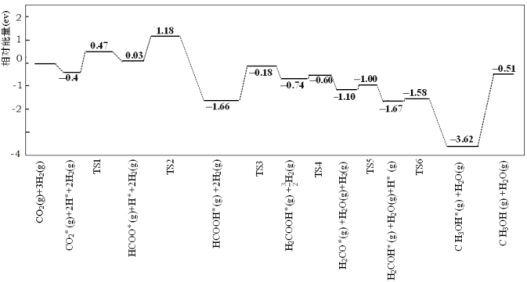
下列说法正确的是
A.该反应的△H>0
B.经历 TS1,CO2共价键发生断裂,且生成羧基
C.能垒(活化能)为 1.48ev 的反应为 HCOOH*(g)+2H2(g)=H2COOH*(g)+![]() H2(g)
H2(g)
D.如果换用铜系催化剂,所得反应历程与上图相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____。
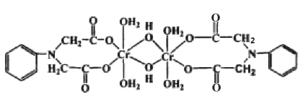
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________,配体中采取sp3杂化的元素是__________。
(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。
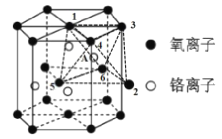
①该氧化物的化学式为 ______。
②该晶胞有 _____%八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为____g·cm-3(用含a、b和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定氢氧化钠和碳酸钠固体混合物样品中碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案是:将m g样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体为n g。
(1)混合物中碳酸钠的质量分数为_____(用m、n表示),甲同学洗涤沉淀的具体操作是_____。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是①________;②BaCO3的摩尔质量比CaCO3的大,与等质量的Na2CO3反应,Ba2+产生沉淀的质量大,称量误差小。
Ⅱ.乙同学的方案的实验装置如图所示:
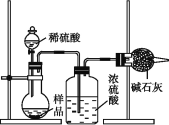
(1)盛有浓硫酸的装置的作用是______。
(2)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法:______(简单叙述做法,不必画图)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是
A.原子半径由小到大的顺序为![]()
B.X的简单氢化物的热稳定性比W的强
C.化合物YX、![]() 、
、![]() 中化学键的类型相同
中化学键的类型相同
D.W的最高价氧化物对应水化物的酸性比Z的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com