
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() 2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
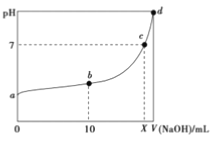
A. X=20
B. a点溶液中c(H+)=2.14×10-3molL-1
C. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(NO2-)
D. 水的电离程度b>d
【答案】B
【解析】
A.向20mL0.01molL-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20mL,c点溶液呈中性,溶质为HNO2、NaNO2混合溶液,X<20mL,故A错误;
B.a点为0.01molL-1HNO2溶液,由HNO2H++NO2-,K=![]() ≈
≈![]() ,4.6×10-4≈
,4.6×10-4≈![]() ,得到c(H+)=2.14×10-3mol/L,故B正确;
,得到c(H+)=2.14×10-3mol/L,故B正确;
C.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1∶1;由NO2-+H2OHNO2+OH-,HNO2H++NO2-,溶液呈酸性,可知电离程度大于水解程度,离子浓度大小为c(NO2-)>c(Na+)>c(HNO2)>c(H+)>c(OH-),故C错误;
D.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1∶1,溶液呈酸性,可知电离程度大于水解程度,说明水的电离受到抑制;b到恰好完全反应时,水的电离程度逐渐增大;氢氧化钠溶液体积为20mL时恰好反应,当氢氧化钠过量后,水的电离又受到抑制;从图中无法判断d点在恰好反应之前还是恰好反应之后,因此无法比较b、d两点的水的电离程度,故D错误;
答案选B。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近
B. 邻二甲苯和液溴在光照下取代产物可能为
C. 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂中的操作
D. 常用质谱法进行有机物相对分子质量的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
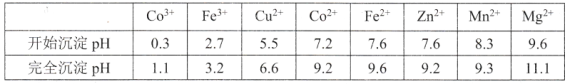
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3的作用是_________,相关的离子方程式为__________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为__________________(写化学式)。滤液3经过多次萃取与反萃取制备CoCl2晶体
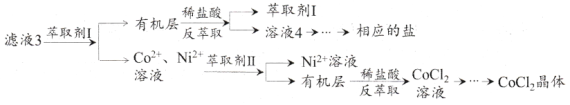
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是___________________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素的原子(以R表示)与A原子结合形成RA3气态分子,其空间构型呈三角锥形。PCl5在气态和液态时,分子结构如下图所示,下列关于PCl5分子的说法中不正确的是( )
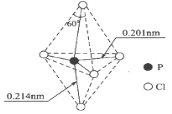
A. 每个原子都达到8电子稳定结构,且为非极性分子
B. 键角(∠Cl—P—Cl)有120°、90°、180°几种
C. PCl5受热后会分解生成分子空间构型呈三角锥形的PCl3
D. 分子中5个P—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu。
①画出装置图:___。
②电极材料和电解质溶液各是什么___。?
③写出电极反应式:负极:___;正极:___。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___L(标准状况下)。导线中通过___mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
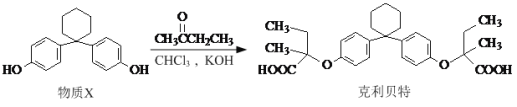
下列有关叙述正确的是
A. 克利贝特的分子式为C28H34O6
B. B.物质X分子中所有碳原子可能位于同一平面内
C. 用NaOH溶液可以鉴别物质X和克利贝特
D. 物质X中无手性碳原子,克利贝特中有两个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸的结构如图所示,关于咖啡酸的描述不正确的是( )
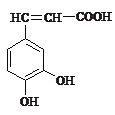
A. 分子式为C9H8O4
B. 1mol咖啡酸最多能与4mol氢气发生加成反应
C. 遇浓溴水,既能发生取代反应又能发生加成反应
D. 1mol咖啡酸最多能与3mol碳酸氢钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com