
【题目】镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO![]()
下列说法正确的是( )
A. NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B. 充电过程中OH-从阳极向阴极迁移
C. 充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D. NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
【答案】A
【解析】试题分析:镍氢电池中主要为KOH作电解液 充电时,阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O,阴极反应:M+H2O+e-=MH+OH-,总反应:M+Ni(OH)2=MH+NiOOH;放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH-=M+H2O+e-,总反应:MH+NiOOH=M+Ni(OH)2。以上式中M为储氢合金,MH为吸附了氢原子的储氢合金。A、正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-,A正确;B、H2O中的H得电子,不是被M还原,B错误;C、电解时阴离子向阳极移动,阳离子向阴极移动,所以OH-离子从阴极向阳极,C错误;D、不能用氨水做电解质溶液,因为NiOOH能和氨水发生反应,D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】25℃时,在密闭容器中合成氨反应如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的2倍,v(正)减小,v(逆)增大,平衡向左移动
C. 1mol N2(g)和3 mol H2(g)的总键能大于2 mol NH3(g)的总键能
D. 在密闭容器中通入1mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:

①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )

A. W、Y、X三种元素的原子半径依次减小
B. Z元素的气态氢化物的热稳定性比Y的高
C. W元素与氢元素可能会形成W2H6
D. Y元素的单质能从NaZ溶液中置换出Z元素的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )

A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )
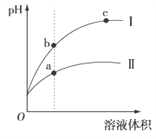
A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)(CH3)2CHCH(CH3)2的系统命名为___________________;
(2)有机物的结构可用“键线式”简化表示,CH3-CH=CH-CH3的键线式为________;
(3)下列化合物分子中,在核磁共振氢谱图中能给出一种信号的是(______)
A.CH3CH2CH3 B. CH3COCH2CH3 C.CH3CH2OH D.CH3OCH3
(4)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 (______)
A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应
(5)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成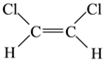 和
和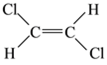 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com