
【题目】近年来,在西藏自治区的铜金多金属成矿带多次发现罕见的金属互化物。金属互化物是合金中的一种,可表示为如Cu-Ni-Zn 或CaCux等形式。
(1)某种金属互化物具有自范性,原子在微观空间里呈现周期性的有序排列,该金属互化物属于____________(填“晶体”或“非晶体”)。
(2)铜在元素周期表中的位置是____________,基态Cu原子核外有__________种能量不同的电子。
(3)Ni2+能与许多配体形成配合物,如[Ni(CN)4]2-、二丁二酮肟合镍(Ⅱ)等。
①写出一种与CN-互为等电子体的分子:_______________(用化学式表示)。
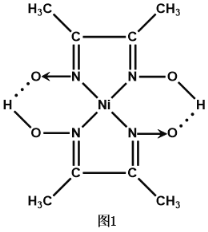
②二丁二酮肟合镍(Ⅱ)的结构如图1所示,Ni的配位数为____________,配位原子为____________,其中C原子的杂化方式为_____________。
(4)甲烷、氨气和水分子中的C、N、O原子均采用sp3杂化,VSEPR模型均为正四面体构型,比较三种分子的键角由大到小的顺序为_________,其原因是__________。
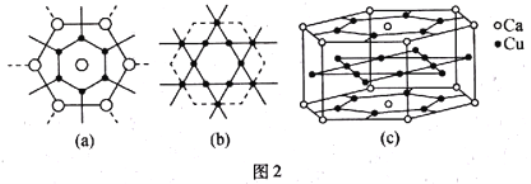
(5)CaCux可看作由如图2所示(a)(b)两种原子层交替堆积排列而成,图(c)表示CaCux晶胞结构图。合金CaCux中x=____________。已知同一层中Ca、Ca原子间的距离均为294pm,根据图示求同层的Ca、Ca原子间的距离为____________pm(取![]() =1.73,结果保留整数)。
=1.73,结果保留整数)。
【答案】晶体 第四周期IB族 7 CO(或N2) 2 N sp2、sp3 CH4>NH3>H2O CH4、NH3、H2O分子中分别含0、1、2对孤对电子,孤电子对与成键电子对间的排斥力大于成键电子对与成键电子对间的排斥力,孤电子对数越多,斥力越大,键角越小 5 509
【解析】
(1)晶体具有自范性,而非晶体无自范性,因晶体中的原子在微观空间里呈现周期性的有序排列,故该金属互化物属于晶体。
(2)铜位于元素周期表第四周期IB族,铜原子的核外电子排布式为1s22s22p63s23p63d104s1,不同能级上电子能量不同,Cu共有7个能级,故基态Cu原子核外有7种能量不同的电子。
(3)①与CN-互为等电子体的分子有CO、N2。②由题图可知,N原子与O原子之间形成了2个配位键,根据成键原理可知N原子与Ni原子之间形成2个配位键(如图),则Ni的配位数为2,因N原子有一对孤电子,则N原子为配位原子;其中-CH3中碳原子的价层电子对数为4,杂化方式为sp3,另一种碳原子的价层电子对数为2+1=3,杂化方式为sp2,故碳原子的杂化方式为sp2、sp3。
(4)甲烷、氨气和水分子中的C、N、O原子均采用sp3杂化,VSEPR模型均为正四面体构型,其差异为中心原子形成的成键电子对数与孤电子对数。电子对之间的排斥力大小关系为孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对。CH4分子中均为成键电子对,NH3分子中含3对成键电子和1对孤对电子,H2O分子中含2对成键电子和2对孤对电子,孤电子对数越多,斥力越大,键角越小,故CH4、NH3、H2O三种分子的键角由大到小的顺序为CH4>NH3>H2O。
(5)由题图(c)可知,该晶胞中Ca原子数目为1/6×12+1/2×2=3,Cu原子数目为1/2×18+6=15,则Ca、Cu原子个数比为3︰15=1︰5,合金CaCux中x=5。设同层Ca、Ca原子间的距离为dpm,结合几何关系分析(如图),可列出关系式:1/2d=![]() /2×294,解得d≈509,故同层Ca、Ca间的距离为509 pm。
/2×294,解得d≈509,故同层Ca、Ca间的距离为509 pm。



科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)NH2COONH4(s) ΔH<0。
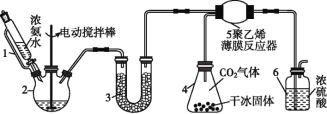
(1)仪器3中盛装的固体是____,其作用是________________。
(2)仪器6的一个作用是控制原料气按化学计量数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该___(填“加快”“减慢”或“不改变” )产生氨的速率。
(3)另一种制备氨基甲酸铵的反应装置(液态石蜡和CCl4均充当惰性介质)如图所示。
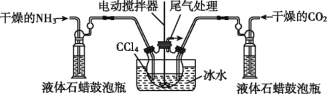
①液态石蜡鼓泡瓶的作用是________________________。
②当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是___(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入____________ | _____________,则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8 g氨基甲酸铵样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥,测得沉淀的质量为1.97 g。则样品中氨基甲酸铵的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
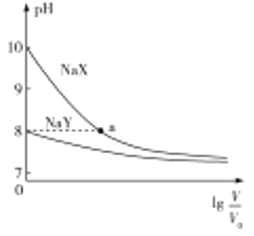
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
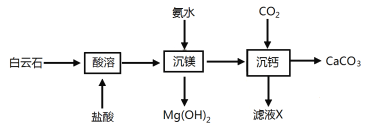
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学学习中起到了重要的作用。已知下列物质:①NaOH溶液、②NO2、③Fe(OH)3、④熔融NaCl、⑤SO2、⑥氨水。回答下列相关问题:
(1)属于混合物的有______________________(填序号,下同)。
(2)属于电解质的有_________________。
(3)能导电的有_____________________。
(4)实验室制备少量Fe(OH)3胶体的离子方程式是_____。
(5)实验室用NaOH溶液吸收NO2的化学方程式为2NO+2NaOH=NaNO2+ NaNO3+H2O,则该反应中氧化剂与还原剂的物质的量之比为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备并收集干燥、纯净氯气的装置如图所示:

(1)写出实验室制备Cl2的化学方程式:___。
(2)写出指定试剂的名称,C__,D__。
(3)C的作用是__,D的作用是__,F的作用是___。
(4)检验氯气是否收集满的操作:___。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是___,若反应产生0.5mol Cl2,则消耗的氧化剂的物质的量为___mol,反应转移的电子数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
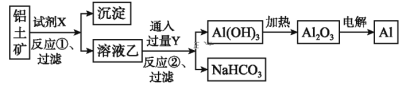
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com