
| C |
| D |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、电离常数:K(HCN)<Ka2(H2CO3) |
| B、浓度均为0.1mol?L-1的NaCN和NaHCO3溶液的pH:NaCN<NaHCO3 |
| C、浓度均为0.1mol?L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D、pH均为10的Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
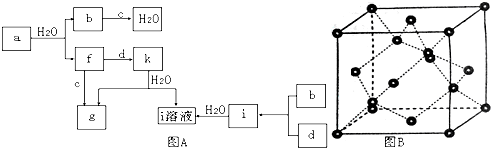
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |


查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、38.5% | B、77% |
| C、6.4% | D、97.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com