
【题目】I.下图是X、Y、Z三种固体物质的溶解度曲线。按要求回答下列问题:
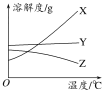
(1)若X溶液中混有少量Y,提纯X的操作_______;
(2)若Y溶液中混有少量的X,提纯Y的操作______。
II.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
有效成分 NaClO
规格 1 000 mL
质量分数 25%
密度 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为_______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。
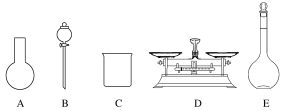
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
【答案】加热浓缩,冷却结晶,过滤 蒸发结晶,趁热过滤 4.0 0.04 C 4.6 250
【解析】
(1)若X溶液中混有少量Y,根据溶解度曲线,X的溶解度受温度的影响较大,Y的溶解度受温度的影响变化不大,应采用加热浓缩,冷却结晶,过滤提纯X,故答案为:加热浓缩,冷却结晶,过滤;
(2)若Y溶液中混有少量的X,根据溶解度曲线,Y的溶解度受温度影响较小,X的溶解度受温度的影响较大,杂质X温度高时溶解度较大,应采用蒸发结晶,趁热过滤提纯Y,故答案为:蒸发结晶,趁热过滤;
II. (1)由标签可知84消毒液的质量分数25%,密度1.19 g·cm-3,该“84消毒液”的物质的量浓度c(NaClO)=![]() ,故答案为:4.0;
,故答案为:4.0;
(2) 该“84消毒液”通常稀释100倍(体积之比)后使用,稀释后的浓度是原浓度的![]() ,即稀释后次氯酸钠的浓度为
,即稀释后次氯酸钠的浓度为![]() ,稀释后的溶液中c(Na+)=c(NaClO)=
,稀释后的溶液中c(Na+)=c(NaClO)= ![]() ,故答案为:0.04;
,故答案为:0.04;
(3) A.配制溶液时需用天平称取溶质质量,在烧杯中溶解,冷却后玻璃棒引流到容量瓶中,加水定容时还要用到胶头滴管,因此如图所示的仪器中,圆底烧瓶和分液漏斗是不需要的,还需要两种玻璃仪器:玻璃棒和胶头滴管,故A错误;
B.容量瓶烘干会对其体积产生影响,故B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致烧杯玻璃棒上粘有的溶质损失,导致结果偏低,故C正确;
D.欲用NaClO固体配制480 mL溶液,但实验室中没有该规格的容量瓶,根据近且大的选取原则,应选用500mL容量瓶配制,需要称量NaClO固体的质量应按照500mL溶液计算,m(NaClO)=![]() ,故D错误;
,故D错误;
故答案为:C;
(4) ①所配制的稀硫酸为2 L 2.3 mol·L-1,硫酸是强酸完全电离,则H+的物质的量浓度为硫酸浓度的2倍,即4.6 mol·L-1,
故答案为:4.6 mol·L-1;
②98%(密度为1.84 g·cm-3)的浓硫酸的物质的量浓度=![]() ;根据稀释定量
;根据稀释定量![]() ,V(浓)=
,V(浓)=![]() ,故答案为:250;
,故答案为:250;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是![]()
![]()
A.常温下,![]() 的甲酸溶液的
的甲酸溶液的![]() 与
与![]() 的氨水溶液中由水电离产生的
的氨水溶液中由水电离产生的![]() 相等
相等
B.中和 ![]() 醋酸与中和
醋酸与中和 ![]() 的醋酸所需同种碱溶液的物质的量不同
的醋酸所需同种碱溶液的物质的量不同
C.向![]() 溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中![]() 增大,导电能力增强
增大,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
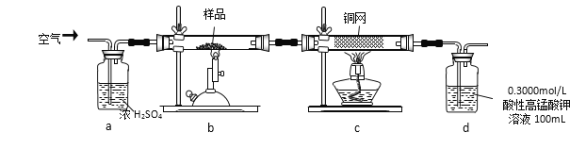
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
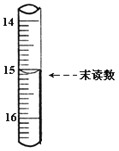
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
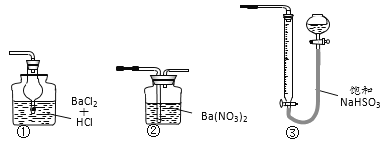
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.弱电解质溶液中至少存在两种共价化合物分子
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.![]() 属于非电解质,但其水溶液能够导电
属于非电解质,但其水溶液能够导电
D.同位素单质混合在一起一般是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
B.56g铁片投入足量浓H2SO4中生成NA个SO2分子
C.2mol SO2和1mol O2在一定条件下充分反应后,混合物中SO3的分子数小于2NA
D.标准状况下,22.4L NO2气体中所含分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A.含硫物种B表示HS-
B.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C.X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值
D.NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-===CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
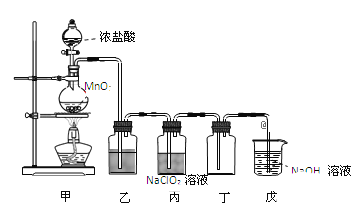
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A (g)+B (g) ![]() 2C(g) +D(s)反应中,表示该反应速率最快的是
2C(g) +D(s)反应中,表示该反应速率最快的是
A. v(A)=0.8mol/(Ls) B. vB=0.3mol/(Ls) C. vC=0.6mol/(Ls) D. vD=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com