
����Ŀ��I.NO��һ�ֳ����������������о�������Ҫ�ļ�ֵ�����塣
��1��2NO(g)+O2(g)=2NO2(g) ��H=akJ/mol�ķ�Ӧ�����������仯��ϵ��ͼ��ʾ��
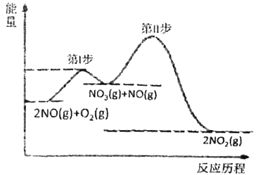
��a___0(���)
����֪���ڢ�ӦΪ��NO3(g)+NO(g)=2NO2(g) ��H=bkJ/mol
��I����Ӧ���Ȼ�ѧ����ʽΪ___��
��2������β���г�����NO��NH3�ڼ��Ⱥʹ������ڵ�������������NO����Ⱦ��
��֪��4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol
NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ___��
��3����ҵ��NO����Ҫ��Դ��NH3��NH3Ҳ����Ϊȼ����Ƴɼ���ȼ�ϵ�أ��ڼ��������£�ȼ�ϵ�ز�����ҪΪN2��ȼ�ϵ�ظ����ĵ缫��ӦʽΪ___��������Ϊȼ�ϵĵ�غͺ�̼��������Ϊȼ�ϵĵ����ȣ���Ҫ���ŵ���___��
II.�������ƺͶ��ȷ�![]() �ķ�ˮ��ͨ������װ�ô�������ԭ����ͼ��ʾ��
�ķ�ˮ��ͨ������װ�ô�������ԭ����ͼ��ʾ��
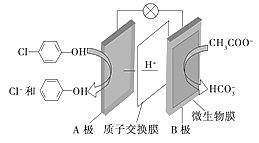
��1��д��HCO3-�ĵ���ʽ___���������к��еĻ�ѧ��������___��
��2����ص�������___����Һ��H+���ƶ�������___(��A��B��B��A)
��3��B�������ĵ缫��Ӧ����ʽΪ___��
���𰸡�< O2(g)+NO(g)=NO3(g) ��H=(a-b)kJ/mol 6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol 2NH3-6e-+6OH-=N2+6H2O �����ͷ���������CO2  ���Ӽ������ۼ� A B��A CH3COO--8e-+4H2O=2HCO3-+9H+
���Ӽ������ۼ� A B��A CH3COO--8e-+4H2O=2HCO3-+9H+
��������
I��(1)�ٷ�Ӧ������������������������������ӦΪ���ȷ�Ӧ��
���ܷ�ӦΪ��2NO(g)+O2(g)�T2NO2(g)��H=akJmol-1���ڢ�Ӧ��NO3(g)+NO(g)�T2NO2(g)��H=bkJmol-1�����ݸ�˹���ɣ��ڢ�Ӧ=�ܷ�Ӧ-�ڢ�Ӧ�õ��ڢ�Ӧ���Ȼ�ѧ����ʽ��
(2)��֪����4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol����4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol�����ݸ�˹���ɿ�֪��![]() -��
-��![]() ���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) �����ɴ˼�����H���ɣ�
���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) �����ɴ˼�����H���ɣ�
(3)NH3Ϊȼ�ϵļ���ȼ�ϵ�أ�������ҪΪN2����ظ�������������Ӧ����̼��������Ϊȼ�ϵĵ�أ�����ΪCO2���壬���������ЧӦ��
II��A����![]() �õ��ӷ�����ԭ��Ӧ����
�õ��ӷ�����ԭ��Ӧ����![]() -OH��˵��AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������B�ǵ�صĸ�����
-OH��˵��AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������B�ǵ�صĸ�����
I��(1)����ͼʾ��֪2NO(g)+O2(g)=2NO2(g)�ķ�Ӧ�����������������������������Ӧ���ȣ��� a��0��
���ܷ�ӦΪ��2NO(g)+O2(g)�T2NO2(g)��H=akJmol-1���ڢ�Ӧ��NO3(g)+NO(g)�T2NO2(g)��H=bkJmol-1���ɸ�˹�����У��ڢ�Ӧ=�ܷ�Ӧ-�ڢ�Ӧ�õ��ڢ�Ӧ���Ȼ�ѧ����ʽO2(g)+NO(g)=NO3(g)��H=(a-b)kJmol-1��
(2)��֪����4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol����4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol�����ݸ�˹���ɿ�֪��![]() -��
-��![]() ���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ������H=(��1268kJ/mol)
���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ������H=(��1268kJ/mol)![]() -(��905kJ/mol)
-(��905kJ/mol)![]() =-1812.5kJ/mol����NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol��
=-1812.5kJ/mol����NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol��
(3)NH3Ϊȼ�ϵļ���ȼ�ϵ�أ�������ҪΪN2����ظ���ΪNH3����������Ӧ���缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O����̼��������Ϊȼ�ϵĵ�أ�����ΪCO2���壬������Ϊȼ�ϵĵ�ؿɼ�С��������CO2�ͷţ�
II��(1)HCO3-�ĵ���ʽΪ �����������Σ������ͻ�������еĻ�ѧ�����������Ӽ������ۼ���
�����������Σ������ͻ�������еĻ�ѧ�����������Ӽ������ۼ���
(2)A����![]() �õ��ӷ�����ԭ��Ӧ����
�õ��ӷ�����ԭ��Ӧ����![]() -OH����AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������Һ��H+���ƶ�������B��A��
-OH����AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������Һ��H+���ƶ�������B��A��
(3)B��Ϊ������CH3COO-����������Ӧ����HCO3-���缫��Ӧ����ʽΪCH3COO--8e-+4H2O=2HCO3-+9H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���NO2��NO��CO���к����壬��ȡ��״����22.4 L����β�����о����ָ�����ͨ����ת���������������к�����ɱ���ȫת��Ϊ����N2��CO2����ȡ�����β��ͨ��0.1 mol/L 50 mL NaOH��Һ�У����е�NO2��NOǡ�ñ���ȫ���ա���β����CO�������������Ϊ(˵��������β���������ɷ�������CO��NaOH��Һ������Ӧ)(����)
A. 0.4% B. 0.8% C. 2% D. 4%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����X(g)��Y(g)���ܱ������н��п��淴Ӧ��X(g)��Y(g) ![]() 2Z(g)��W(s)����H��0������������ȷ���ǡ�������������
2Z(g)��W(s)����H��0������������ȷ���ǡ�������������
A. ƽ�ⳣ��KֵԽ��X��ת����Խ��
B. �ﵽƽ��ʱ����Ӧ����v��(X)��2v��(Z)
C. �ﵽƽ����¶ȣ�����Ӧ���ʼ�С�ı�����������Ӧ���ʼ�С�ı���
D. �ﵽƽ��������¶Ȼ�����ѹǿ�������ڸ÷�Ӧƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ����1mol��������ݣ���
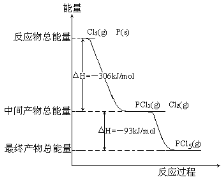
������ͼ�ش��������⣺
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ___��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ___��
��3��P��Cl2��������Ӧ����1molPCl5�ġ�H3��__��P��Cl2һ����Ӧ����1molPCl5�ġ�H4___��H3 (����ڡ�����С�ڡ����ڡ�)��
��4��PCl5������ˮ��ַ�Ӧ���������������ᣬ��֪��Ӧǰ���Ԫ�ػ��ϼ۲��䣬�仯ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������½������·�Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��>0���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�CO2��ת���ʣ���ȡ����ȷ��ʩ�ǣ� ��
CO(g)+H2O(g) ��>0���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�CO2��ת���ʣ���ȡ����ȷ��ʩ�ǣ� ��
A.�Ӵ���B.�����¶�C.����CO2D.����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��(N2H4)�ֳ�����,����ʱ��һ�ֿ�ȼ��Һ��,���������ȼ�ϡ�
��1����֪��25����101kPaʱ��16g N2H4����������ȫȼ�����ɵ������ų�312kJ����������N2H4��ȫȼ�յ��Ȼ�ѧ����ʽ��_______________��
��.��ͼ��ʾ��ij�о���ѧϰС����������ȼ��ԭ�����һ����(N2H4)������ȼ�ϵ��(��ͼ��)��̽��ijЩ��ҵԭ����������װ����XΪ�����ӽ���Ĥ(��ֻ����������ͨ��)��
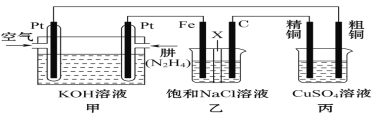
����Ҫ��ش��������:
��2����װ����ͨ��_________�����һ��Ϊ�����������ĵ缫��ӦʽΪ__________��
��3����װ����ʯī�缫Ϊ______������缫��ӦʽΪ___________��������______________����÷�Ӧ���������һ��ʱ������ҳ��е���Һ��__________�ԡ�
��4��ͼ���ñ�װ��ģ�ҵ�е�_____________________ԭ������������װ�þ�ͭ��������3.2g���������ϼ�װ��������������Ϊ____________g��
��5����������еĴ�ͭ�缫��ΪPt�缫��������ܻ�ѧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I����֪��448��ʱ����ӦH2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ
2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ![]() H2(g)��
H2(g)��![]() I2(g)
I2(g)![]() HI(g)��ƽ�ⳣ��K2Ϊ____________��
HI(g)��ƽ�ⳣ��K2Ϊ____________��
��II����һ��������ܱ������н������»�ѧ��Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
t/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��________��
��2���÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��
A.������ѹǿ���� B.���������c(CO)����
C.v��(H2)��v��(H2O) D.c(CO2)��c(CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c(CO2)��c(H2)��c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ________�档
��5����800��ʱ������������Ӧ��ijʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc(CO2)Ϊ2mol��L��1��c(H2)Ϊ1.5mol��L��1��c(CO)Ϊ1mol��L��1��c(H2O)Ϊ3mol��L��1������һʱ�̣���Ӧ��________(���������)���С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL ![]() ����
����![]() ��Һ����μ����Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��pH����ͼ��ϵ������˵����ȷ����( )
��Һ����μ����Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��pH����ͼ��ϵ������˵����ȷ����( )

A.����Һ��ˮ��̶ȴ��ڵ���̶�
B.��V(NaOH) = 10 mLʱ��Һ�д��ڣ�![]()
C.��V(NaOH) = 15 mLʱ����Һ�д��ڣ�![]()
D.��V(NaOH) = 20 mLʱ����Һ�д��ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.��ӦNH3(g)+HCl(g)=NH4Cl(s)�������¿��Է����У���÷�Ӧ����H>0
B.�赥�ʿ��������ά��ԭ��
C.CH3COOH��Һ��ˮϡ�ͺ���Һ��![]() ��ֵ��С
��ֵ��С
D.Na2CO3��Һ�м�������Ca(OH)2���壬CO32-ˮ��̶ȼ�С����ҺpH��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com