
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
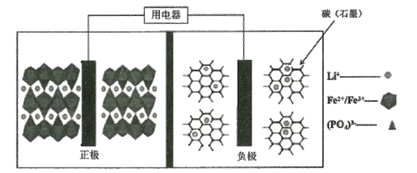
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,当导线中传递l mol电子,理论上将有1 mol Li+向左移动
【答案】D
【解析】
该电池的总反应式是:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC,在正极上得电子,其正极反应为:xFePO4+xLi++xe-=xLiFePO4,负极反应为:LixCn- xe-=nC+ xLi+,充电时的两极反应和放电时正好相反,据此回答。
LiFePO4+nC,在正极上得电子,其正极反应为:xFePO4+xLi++xe-=xLiFePO4,负极反应为:LixCn- xe-=nC+ xLi+,充电时的两极反应和放电时正好相反,据此回答。
A、由分析可知,放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4,故A正确;
B、放电时时,电子由负极经导线、用电器、导线到正极,故B正确;
C、充电时,阴极的反应与负极相反,所以阴极电极反应式为:xLi++xe-+nC=LixCn,故C正确;
D、充电时,阳离子向阴极移动,即向右移动,故D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
A.c(I-)=2a mol·L—1
B.v (I-)=2v(AsO43-)
C.c(AsO43-)/c(I-)不再变化
D.溶液的pH不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )

A.若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
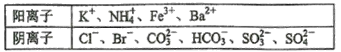
现进行如下实验操作(每次实验所加试剂均过量)
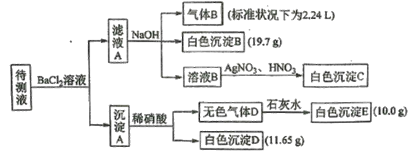
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
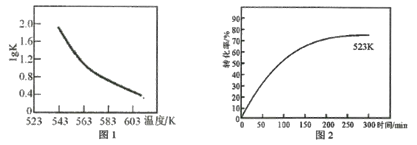
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
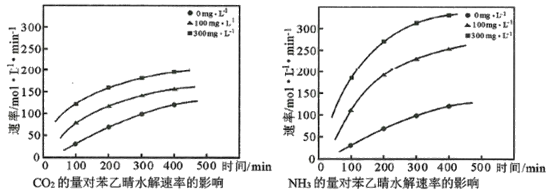
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
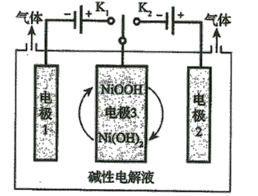
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
A. 实验室用装置A制取并收集二氧化硫
实验室用装置A制取并收集二氧化硫
B.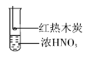 装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
C.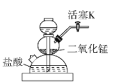 装置C可用于二氧化锰与浓盐酸反应制备氯气
装置C可用于二氧化锰与浓盐酸反应制备氯气
D.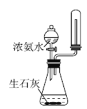 实验室用装置D制取少量氨气
实验室用装置D制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com