
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
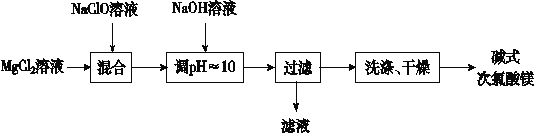
(1)上述流程中过滤操作需用的玻璃仪器有__________
(2)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(3)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:______________。
【答案】漏斗,烧杯,玻璃棒 NaCl Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
整个反应2MgCl2 + NaClO + 3NaOH + H2O = Mg2ClO(OH)3·H2O↓ + 4NaCl,过滤后滤液为氯化钠,得到的Mg2ClO(OH)3·H2O经过洗涤、干燥。
⑴上述流程中过滤操作需用的仪器主要是漏斗,烧杯,玻璃棒、滤纸、铁架台,而需要的玻璃仪器有漏斗,烧杯,玻璃棒,故答案为:漏斗,烧杯,玻璃棒;
⑵根据反应和质量守恒定律得出,滤液中可回收的主要物质是NaCl,故答案为:NaCl;
⑶ Cl2与NaOH溶液反应得到NaClO和氯化钠,该反应的化学方程式Cl2+2NaOH = NaCl +NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]()
![]() +KOH+
+KOH+
2MnO2↓+H2O
![]() +HCl
+HCl![]()
![]() +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
![]()
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 | |
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, | | 白色晶体 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃的相对分子质量为72,其分子式为_________。若该烷烃不能由任何一种烯烃与H2发生加成反应而得到,则该烷烃的结构简式为___________________。
(2)有机物A的结构简式为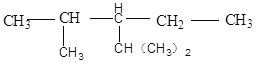 ,该有机物系统命名是______________________。1mol该烃完全燃烧需消耗氧气________mol,该烃一氯代物有________种。
,该有机物系统命名是______________________。1mol该烃完全燃烧需消耗氧气________mol,该烃一氯代物有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制1 mol/L的氢氧化钠溶液250mL,完成下列部分步骤:
①用天平称取氢氧化钠固体__________克。
②将称好的氢氧化钠固体放入小烧杯中加适量蒸馏水将其溶解,待冷却后将溶液沿玻璃棒转移入__________的容量瓶中。
③用少量蒸馏水冲洗玻璃棒及烧杯2~3次,将冲洗液移入容量瓶中。
④向容量瓶内加水至刻度线1~2cm时,改用__________小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲酸的反应如下:
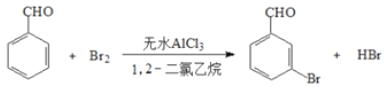
已知:(1)间溴苯甲醛温度过高时易被氧化
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
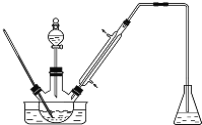
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如下图所示)缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液、有机层用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是____________,锥形瓶中应为__________(填化学式)溶液
(2)步骤1反应过程出,为提高原料利用率,适宜的温度范围内(填序号)____________
A.>299℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的____________(填化学式)
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏,是为了防止_______________________________________。
(6)若实验中加入5.3g苯甲醛,得到3.7g间溴苯甲醛,则间溴苯甲醛产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某校研究性学习小组的学生欲制取、收集氨气,并探究氨气的有关性质,请你参与回答实验中的有关问题。
①要收集较纯的干燥氨气,使用的方法是__________________________。
②甲、乙两小组的学生用相同容积的圆底烧瓶各收集一瓶干燥氨气,进行实验.结果都产生了喷泉,说明氨气______溶于水;圆底烧瓶中溶液变红色,说明有_____性物质生成。
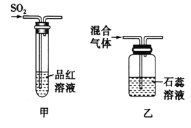
(2)某兴趣小组为验证SO2和Cl2的漂白性,设计了如下方案,请你参与回答下列问题(尾气处理装置未画出)_____。
①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液又变为红色,说明SO2的漂白是__________(填“可恢复的”或“不可恢复的”)。
②如图乙所示,将干燥的Cl2和SO2按其体积比1:1混合,通入石蕊溶液中,发现石蕊溶液变红,不褪色,试用化学方程式解释之:_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25 ℃时,a g该晶体能够溶于b g水中形成V mL饱和溶液。下列关系中不正确的是( )
A. 该溶液的密度为ρ=![]() g·L-1
g·L-1
B. 该溶液的物质的量浓度为c=![]() mol·L-1
mol·L-1
C. 该溶液中溶剂与溶质的质量比为m(水)∶m(溶质)=![]() ∶
∶![]()
D. 该溶液中溶质的质量分数为w=![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
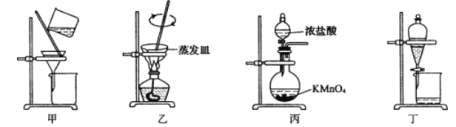
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com