
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
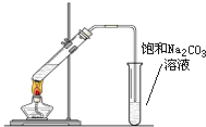
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是:_______;
(2)乙酸乙酯在饱和碳酸钠溶液的_______层;(填“上”或“下”)
(3)浓硫酸的作用是______________;
(4)制取乙酸乙酯的化学方程式是______,该反应属于___ (填反应类型)反应;
(5)饱和碳酸钠的作用是:________________;
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
【答案】先加乙醇再加浓硫酸最后加乙酸 上 催化剂和吸水剂 CH3CH2OH+CH3COOH![]() CH3COOCH3CH3+H2O 酯化反应 中和酸溶解醇降低乙酸乙酯的溶解度 ①③
CH3COOCH3CH3+H2O 酯化反应 中和酸溶解醇降低乙酸乙酯的溶解度 ①③
【解析】
(1)结合浓硫酸的稀释的方法分析解答;
(2)乙酸乙酯的密度小于水,且不溶于水;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(5)碳酸钠能够与乙酸反应,乙醇易溶于水,碳酸钠的存在可以降低乙酸乙酯在水中的溶解度;
(6)根据化学平衡的特征分析判断。
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,方法为:先在大试管中加入乙醇,然后慢慢向其中注入浓硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,故答案为:先加乙醇再加浓硫酸最后加乙酸;
(2)乙酸乙酯的密度小于水,且不溶于水,因此乙酸乙酯在饱和碳酸钠溶液的上层,故答案为:上;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,故答案为:催化剂和吸水剂;
(4)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O;酯化反应;
CH3COOC2H5+H2O;酯化反应;
(5)饱和碳酸钠溶液的主要作用是中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,故答案为:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度;
(6)①混合物中各物质的浓度不再变化,为平衡的特征,可知达到平衡状态,故①选;②单位时间里,生成1mol乙醇,同时生成1mol乙酸,不能体现正、逆反应速率关系,不能判定平衡状态,故②不选;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,可知正、逆反应速率相等,为平衡状态,故③选;故答案为:①③。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
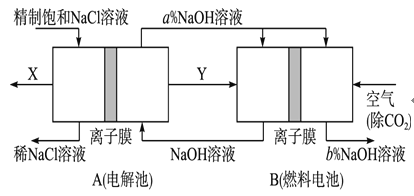
①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______b%(填>、=或<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扑热息痛是一种优良的解热镇痛剂,其结构简式为 ,以下对它的叙述中错误的是( )
,以下对它的叙述中错误的是( )
A. 能与烧碱溶液反应
B. 能与浓溴水发生取代反应
C. 能发生水解反应
D. 能发生加聚反应形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
D. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(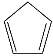 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应不符合绿色化学原子经济性要求的是( )
A. ![]() +HCl→CH2=CHCl
+HCl→CH2=CHCl
B. CH2=CH2+1/2O2![]()
![]()
C. ![]() +Br2
+Br2![]() +HBr
+HBr
D. CH2=CH2+HCl→CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2;
⑥混合气体的平均相对分子质量不变
A. ②④⑤ B. ①③④⑥ C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com