
 在如图所示的物质转化关系中,A是海水中含量 最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种白色凝胶状沉淀.(部分生成物和反应条件为列出)
在如图所示的物质转化关系中,A是海水中含量 最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种白色凝胶状沉淀.(部分生成物和反应条件为列出)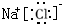 ,故答案为:
,故答案为: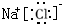 ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| 分子中所有的化学键 | 峰面积之比 | |
| 红外光谱 | N-N N-C N-H C-H |  |
| 核磁共振氢谱 |  | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 是一种高分子材料,其单体的结构简式是
是一种高分子材料,其单体的结构简式是
查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性气态氧化物 |
| 3 | F的浓溶液常做干燥剂 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
| B、20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) |
| D、0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b>a>d>c |
| B、b>a=d>c |
| C、a=b>c>d |
| D、c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、环保等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示,下列关于氨固体氧化物燃料电池的说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、环保等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示,下列关于氨固体氧化物燃料电池的说法正确的是( )| A、该电池工作时的总反应为4NH3+5O2═4NO+6H2O |
| B、固体氧化物作为电池工作的电解质,其作用便于电子在电池内移动 |
| C、电池工作时,在接触面上发生的电极反应为4NH3+3O2--6e-═N2+3H2O |
| D、外电路的电流方向为从电极a流向电极b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com