
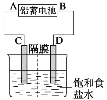
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
已知:铅蓄电池在放电时发生下列电极反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为__极。
(3)用铅蓄电池电解200ml浓度为0.5mol/LCuSO4 溶液一段时间后
①若两极收集到的气体体积相等,则转移电子_____mol。
②阳极收集到的气体体积(标准状况下)为_____L。
【答案】2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 正 0.4 2.24
2NaOH+Cl2↑+H2↑ 正 0.4 2.24
【解析】
(1)惰性电极电解饱和食盐水得到氢氧化钠、氢气和氯气;
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明C极为阳极,据此判断铅蓄电池的A极;
(3)用铅蓄电池电解200ml浓度为0.5mol/LCuSO4 溶液一段时间后,阳极只产生氧气,阴极先析出铜、后析出氢气,按电子数守恒及其它已知条件计算即可。
(1)依据电解的原理可得,电解饱和食盐水的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(2)惰性电极电解饱和食盐水,阴极水提供的氢离子放电,产生氢气,溶液中氢氧根离子浓度增大,阳极产生氯气,若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明C极为阳极,所以铅蓄电池的A极为正极;
(3)用铅蓄电池电解200ml浓度为0.5mol/LCuSO4 溶液,阳极只产生氧气,阴极先析出铜、后析出氢气;①若两极收集到的气体体积相等,即气体的物质的量相等,则设阳极为: ,阴极析出氢气的物质的量为x,
,阴极析出氢气的物质的量为x,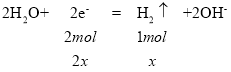 ,则
,则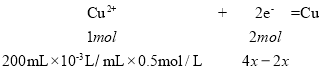 ,则x=0.1mol,故转移电子的物质的量4x=0.4mol;
,则x=0.1mol,故转移电子的物质的量4x=0.4mol;
②阳极收集到的气体为0.1mol的氧气,标况下的体积为2.24L。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)常温下,将m mol·L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合后,溶液的pH=7,则m与n的大小关系是m____n(填“>”、“<”或“=”,下同),原酸中c(H+)与碱中c(OH-)的大小关系是c(H+)____c(OH-)。
(2)常温下,将浓度均为0.1mol·L-1的CH3COONa、CH3COOH溶液等体积混合后,溶液呈酸性。则混合溶液中各离子浓度由大到小排序为_____。关于该混合溶液的说法不正确的是___(填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
b.此溶液一定有c(Na+)=c(CH3COOH)+c(CH3COO-)
c.此溶液中水的电离程度一定大于纯水的电离程度
d.向此溶液中加少量氢氧化钠或盐酸,溶液pH变化不大
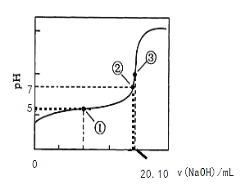
(3)用0.1000 mol·L-1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,滴定曲线如右图所示。其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。列式并计算醋酸的电离常数_____,CH3COOH的物质的量浓度为____ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
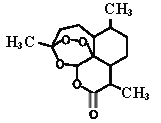
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )

A.铍、钠、铝B.硼、镁、硅C.碳、铝、磷D.氧、磷、氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
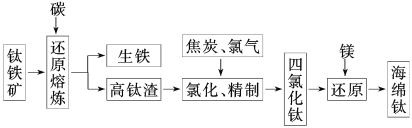
(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应:FeTiO3+C![]() TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为________。
TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为________。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:___________,还原产物是____________。
(3)用镁在高温下还原四氯化钛,该反应的环境要求是__________;写出化学方程式:___________。
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。
①写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:______________;
②写出电解熔融氯化镁的电解方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒温密闭容器中发生反应![]() ;经2min,B的浓度减少
;经2min,B的浓度减少![]() 。对此反应的下列表述不正确的是( )
。对此反应的下列表述不正确的是( )
A.用A表示的反应速率是![]()
B.用B表示的反应速率是![]()
C.在2min末时,容器内压强不变
D.在这2min内C和D两物质浓度都逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com