
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中Na+的浓度为____。
(2)将0.1mol·L-1的K2SO4溶液、0.2mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、SO42-的浓度分别为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比___。(忽略体积的变化)
【答案】0.3mol·L-1 2:1:1
【解析】
(1)设混合溶液体积为1 L。n(Al3+)=c·V=0.1 mol·L-1×1 L=0.1 mol,n(SO![]() )=n(Ba2+)=0.3 mol·L-1×1 L=0.3 mol。由电荷守恒可得:3n(Al3+)+n(Na+)=2n(SO
)=n(Ba2+)=0.3 mol·L-1×1 L=0.3 mol。由电荷守恒可得:3n(Al3+)+n(Na+)=2n(SO![]() ),所以n(Na+)=2n(SO
),所以n(Na+)=2n(SO![]() )-3n(Al3+)=2×0.3 mol-3×0.1 mol=0.3 mol,c(Na+)=
)-3n(Al3+)=2×0.3 mol-3×0.1 mol=0.3 mol,c(Na+)=![]() =
=![]() =
=![]() =0.3 mol·L-1,故答案为:0.3mol·L-1;
=0.3 mol·L-1,故答案为:0.3mol·L-1;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),解得x=2y=2z,所以K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2∶1∶1,故答案为:2∶1∶1。


科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
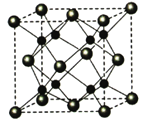
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述错误的是( )
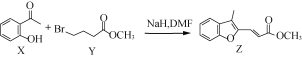
A.X中所有原子不可能在同一平面B.X、Z均能与酸性KMnO4溶液反应
C.Y含有羧基的同分异构体有12种D.室温下Z与Br2加成的产物最多有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________,属于_____区,基态Ag原子的价电子排布式为__________。
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是______(填名称),配体阴离子的空间构型是______,中心原子采用_____杂化。
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4_____ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为______(用化学式表示),其结构原因是______。
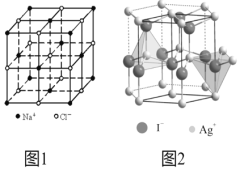
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为______,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______。
a. 几何因素 b. 电荷因素 c. 键性因素
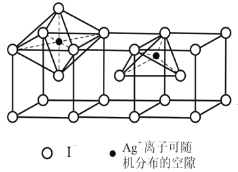
(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)= ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是
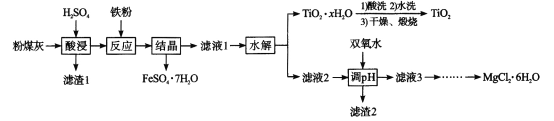
A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2![]() xH2O产率降低
xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2![]() 6H2O需要在HCl的气氛下蒸发浓缩
6H2O需要在HCl的气氛下蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③NaOH(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3
A.①③
B.②③
C.②④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
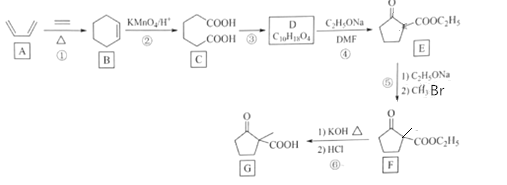
已知:R1CH2COOCH2CH3+R2COOCH2CH3![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是__。
(2)反应②和⑤的反应类型分别是__、__。
(3)写出C到D的反应方程式__。
(4)E的分子式__。
(5)F中官能团的名称是__。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式___。
(7)设计由乙酸乙酯和1,4-二溴丁烷制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com