
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,只有W为金属元素。甲、乙、丙分别为X、Z、W三种元素所对应的单质。A、B、C、D均为由X、Y、Z三种元素组成的化合物,化合物B的稀溶液常用于保存动物标本。它们的转化关系如图所示。下列说法错误的是

A.X与Z可组成非极性分子
B.原子半径大小关系是:r(X)<r(Z)<r(Y)<r(W)
C.四种化合物中B的沸点最低
D.四种化合物中Y原子的杂化方式有2种
【答案】A
【解析】
由“化合物B的稀溶液常用于保存动物标本”,可确定B为HCHO,则X、Y、Z分别为H、C、O;由“甲、乙、丙分别为X、Z、W三种元素所对应的单质”,可确定甲、乙分别为H2、O2;由转化关系图,可确定A为CH3OH,C为HCOOH,D为HCOOCH3;由A与丙反应可生成甲,可确定丙为Na,即W为Na。
A.X与Z分别为H和O,二者可组成H2O、H2O2,它们都是极性分子,A错误;
B.H的核外只有1个电子层,半径最小,C、O同周期,C在O的左边,原子半径C比O大,Na的电子层数最多,半径最大,所以原子半径大小关系是:r(H)<r(O)<r(C)<r(Na),B正确;
C.四种化合物中,B为HCHO,常温下呈气态,而另三种物质都呈液态,所以B的沸点最低,C正确;
D.四种化合物中Y原子的杂化方式有:含-CH3的物质,碳原子发生sp3杂化,含碳氧双键的物质,碳氧双键中碳原子发生sp2杂化,D正确;
故选A。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.检验溶液是否含有SO![]() 时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe3+时,用硝酸酸化
D.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某测定O2含量的传感器工作原理如图所示。O2通过聚四氟乙烯膜进入传感器只与AlI3反应生成Al2O3和I2,RbAg4I5固体只传导Ag+,E为电位计。下列说法错误的是
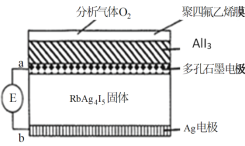
A.电子由a极移动到b极
B.RbAg4I5质量不发生变化
C.b极的电极反应式为:Ag+I--e-=AgI
D.该传感器协同总反应方程式为:3O2+4AlI3+12Ag=2Al2O3+12AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是

A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02evmol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
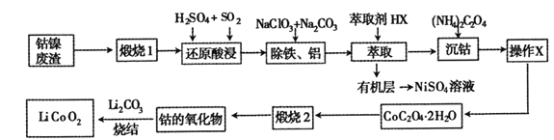
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
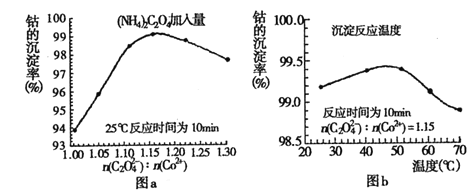
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
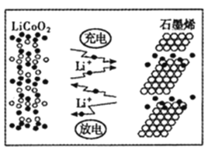
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com