
【题目】异戊醇薄荷酯P(![]() )是一种治疗心脏病的药物。一种制备异戊醇薄荷酯P的流程如下:
)是一种治疗心脏病的药物。一种制备异戊醇薄荷酯P的流程如下:
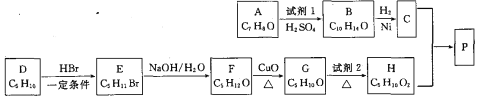
已知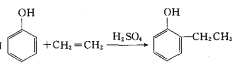 RCH=CH2
RCH=CH2![]() RCH2CHBr(R表示烃基)
RCH2CHBr(R表示烃基)
完成下列问题:
(1)A的化学名称为_____________。
(2)试剂1的结构简式为_____________。
(3)由E生成F的化学方程式为_____________,该反应类型是_____________。
(4)试剂2可以是_____________试剂。(填名称或化学式)
(5)由C和H生成P的化学方程式为_____________。
(6)H的同分异构体中,能发生水解反应的链状化合物共有___________种(不考虑立体异构);其中核磁共振氢谱有两种峰、且蜂值比为9:l的同分异构体的结构简式为_____________。
(7)苯乙烯是一种重要的化工原料。参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:(合成路线常用的表示方式为:![]() _____________。
_____________。
【答案】 3﹣甲基苯酚(间-甲基苯酚) CH3CH=CH2  水解反应或取代反应 新制的银氨溶液或新制的氢氧化铜等合理答案
水解反应或取代反应 新制的银氨溶液或新制的氢氧化铜等合理答案  9
9 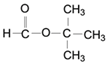
![]()
【解析】由A到B根据原子守恒可知试剂I所含有碳原子数为3,再结合题目信息和有机物P的碳架结构,可知A为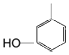 ,试剂I为CH3CH=CH2,生成的B为
,试剂I为CH3CH=CH2,生成的B为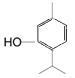 ,B与H2发生加成反应后生成的C为
,B与H2发生加成反应后生成的C为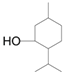 ,C为H发生酯化反应生成
,C为H发生酯化反应生成![]() ,则H为(CH3)2CHCH2COOH,可依次逆G到D的结构简式;
,则H为(CH3)2CHCH2COOH,可依次逆G到D的结构简式;
(1) 的化学名称为间甲基苯酚或3﹣甲基苯酚;
的化学名称为间甲基苯酚或3﹣甲基苯酚;
(2)试剂1的结构简式为CH3CH=CH2;
(3)由E生成F发生的是卤代烃的碱性水解,其化学方程式为 ,反应类型为取代反应;
,反应类型为取代反应;
(4)试剂2的作用是将醛基氧化为羧基,可选择新制的银氨溶液或新制的氢氧化铜等;
(5)由![]() 和(CH3)2CHCH2COOH发生酯化反应生成
和(CH3)2CHCH2COOH发生酯化反应生成![]() 的化学方程式为
的化学方程式为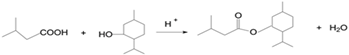 ;
;
(6)(CH3)2CHCH2COOH的同分异构体中,能发生水解反应的链状化合物应为酯,可分为甲酸酯有4种,乙酸酯有2种,丙酸酯有1种,丁酸甲酯有2种,共有9种;其中核磁共振氢谱有两种峰、且蜂值比为9:l的同分异构体的结构简式为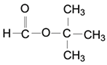 ;
;
(7)苯、乙烯为有机原料制备苯乙烯的合成线路为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、CO32-、NO3- B.K+、MnO4-、NH4+、NO3-
C.NH4+、SO42-、Al3+、NO3- D.Na+、Ca2+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解氧筑化,且在氯离子浓度较大的体系中存在CuCl+Cl-=[CuCl2]-。工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
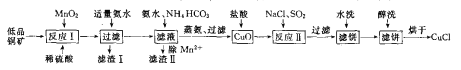
回答下面问题:
(1)反应I中被氧化的元素有_________。(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
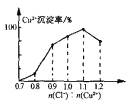
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-): n(Cu2+)]的关系如下图所示。CuCl+Cl-![]() [CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-)
C. a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D. 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是 ____________________。

(2)为防止氯气尾气污染空气,可用 __________________ 溶液吸收多余的氯气。
(3)漂白粉是常用的消毒剂。
① 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为______________________ 。
② 漂白粉的有效成分是(填化学式)__________________________________。
③ 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学方程式为____。
④长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 ____________(填编号)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com