
【题目】氯氧化铋(BiOCl)常用于电子设备等领域,BiOCl难溶于水,它是BiCl3的水解产物。以铋的废料(主要含铋的化合物,含少量铜、铅、锌的硫酸盐及Cu2S和Fe2O3等)为原料生产高纯度BiOCl的工艺流程如下:
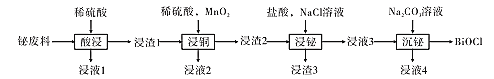
请回答下列问题:
(1)在浸液1中加入过量的锌,过滤,将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥得结晶水合物M,M的摩尔质量为287 g·mol-1,M为 ___(填化学式)。
(2)已知:浸液2呈蓝色,浸渣2含有少量硫单质。“浸铜”中MnO2的作用是____(用离子方程式表示)。
(3)“浸铋”中,铋的浸出率与温度关系如图所示:
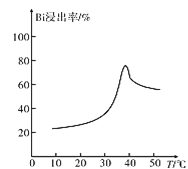
在高于40℃左右时“铋浸出率”开始下降,其主要因素可能是____(从两个角度分析)。
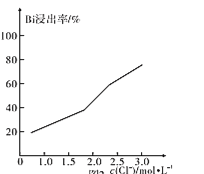
(4)在室温和液固比固定的条件下,c(HCl)=1.0mol·L-1时,铋的浸出率与溶液中c(Cl-)的关系如图所示。“浸铋”操作中,加入NaCl的目的是____。
(5)浸液3中主要溶质是BiCl3,“沉铋”过程中,有气体放出。“沉铋”的主要化学反应的方程式为____。从绿色化学角度看,浸液4可以用于____(填“酸浸”、“浸铜”或“浸铋”)。
(6)测定产品的纯度:取mg充分洗涤并干燥后的产品,溶于稍过量的浓硝酸中,加水稀释到100.0mL,取20.0mL于烧杯中,用cmol·L-1的AgNO3标准溶液滴定至终点(用Na2CrO4,作指示剂),消耗AgNO3标准溶液VmL,则产品中BiOCl的质量分数为____%(用含m、c、V的代数式表示)。
【答案】ZnSO4·7H2O Cu2S+2MnO2+8H+=2Cu2++S+2Mn2++4H2O HCl的挥发加快、Bi3+水解程度增大 增大浸出液中c(Cl-)提高铋浸出率 BiCl3 + Na2CO3=BiOCl↓+ 2NaCl + CO2↑ 浸铋 ![]()
【解析】
铋废料加入稀硫酸酸浸,浸液1中主要含Cu2+、Zn2+、Fe3+等,浸渣1中则主要含有铋的化合物、Cu2S和PbSO4;向浸渣1中加入稀硫酸和MnO2,根据题目信息可知亚铜离子被氧化得到Cu2+,S2-被氧化得到S单质,所以浸渣2中主要含有含铋化合物、S和PbSO4;向浸渣2中加入盐酸和NaCl溶液可以浸出Bi3+,酸性溶液中铋元素主要以Bi3+形式存在,所以浸液3中主要含有Bi3+,浸渣3主要为S和PbSO4;浸液3中加入Na2CO3溶液,溶液碱性增强,Bi3+水解以BiO+离子形式存在,BiO+与Cl-形成BiOCl从溶液中析出,最终得到BiOCl,据此分析解答。
(1)浸液1中主要阳离子为Cu2+、Zn2+、Fe3+等,加入过量锌,Cu2+、Fe3+完全反应,得到纯净的硫酸锌溶液,所以最终得到的结晶水合物为ZnSO4·xH2O,其摩尔质量为287 g·mol-1,则x=![]() ,所以M为ZnSO4·7H2O;
,所以M为ZnSO4·7H2O;
(2)浸液2为蓝色,说明有铜离子生成,即Cu+被MnO2氧化,浸渣2含有少量硫单质,即硫离子被氧化成硫单质,结合电子守恒和元素守恒可知该过程离子方程式为Cu2S+2MnO2+8H+=2Cu2++S+2Mn2++4H2O;
(3)温度升高HCl 的挥发加快、Bi3+水解程度增大,导致高于40℃左右时“铋浸出率”开始下降;
(4)据图可知氯离子浓度越大,铋的浸出率增大,加入氯化钠可以增大浸出液中c(Cl-),提高铋浸出率;
(5)BiCl3的水解使溶液显酸性,碳酸钠水解使溶液显碱性,二者相互促进,最后彻底水解,所以得到的气体应为二氧化碳,发生的反应方程式为:BiCl3 + Na2CO3= BiOCl↓+ 2NaCl + CO2↑;根据方程式可知浸液4中含有大量NaCl,可用于浸铋;
(6)该滴定原理为利用硝酸银标准液滴定BiOCl中氯离子的量,存在数量关系n(BiOCl)=n(AgNO3);所以20.0mL待测液中n(BiOCl)=Vc×10-3mol,则样品中n(BiOCl)=![]() ×Vc×10-3mol=5Vc×10-3mol,所以产品中BiOCl的质量分数为
×Vc×10-3mol=5Vc×10-3mol,所以产品中BiOCl的质量分数为![]() 。
。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
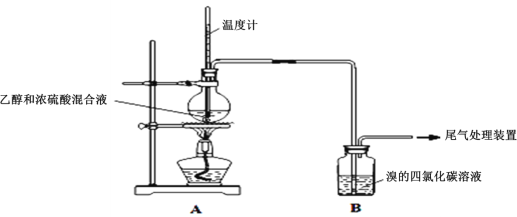
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
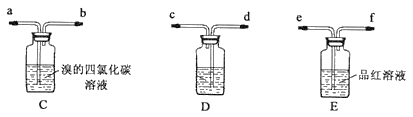
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
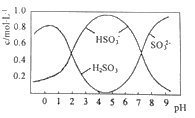
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是
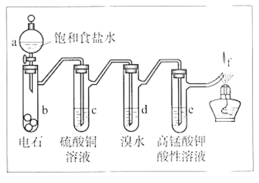
A.制备乙炔的反应原理是CaC2+2H2O→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
D.f处观察到的现象是安静燃烧,火焰呈淡蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、R、D都是周期表中前四周期的元素,它们的原子系数依次增大。其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素。
(1)写出基态D原子的电子排布式__________。
(2)已知高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位。工业上生产高纯度R的单质过程如下:
![]()
写出过程③的反应方程式___________,已知RHCl3的沸点是31.5oC,则该物质的晶体类型是__________,中心原子的轨道杂化类型为__________,该物质的空间构型是______。
(3)A的第一电离能比B的第一电离能大的原因是_________,A、B两元素分别与R形成的共价键中,极性较强的是________。A、B两元素间能形成多种二元化合物,其中与A3-互为等电子体的物质的化学式为_______。
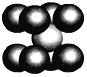
(4)已知D单质的晶胞如图所示,则晶体中D原子的配位数为______,一个D的晶胞质量为____,已知D原子半径为r pm,则该晶胞的空间利用率为_____________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料聚酯纤维H的一种合成路线如下:

已知:CH2=CHCH3![]() CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl
请回答下列问题:
(1)C的名称是____,D的结构简式为____。
(2)E—F的反应类型是____,E分子中官能团的名称是 ___。
(3)写出C和G反应生成H的化学方程式____。
(4)在G的同分异构体中,同时满足下列条件的结构有 ___种(不考虑立体异构)。
①属于芳香族化合物,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应
②1mol该有机物与3molNaOH恰好完全反应
③分子结构中不存在![]()
其中,核磁共振氢谱显示4组峰的结构简式为____。
(5)参照上述流程,以1-丁烯为原料合成HOCH2(CHOH)2CH2OH,设计合成路线____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-正丙基-2,4-二羟基苯乙酮(H)是一种重要的药物合成中间体,合成路线图如下:
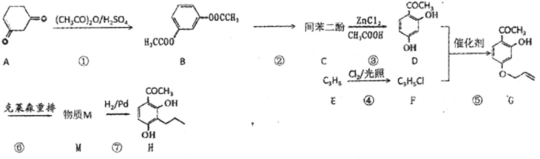
已知:![]() +(CH3CO)2O
+(CH3CO)2O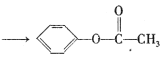 +CH3COOH
+CH3COOH
回答下列问题:
(1)G中的官能固有碳碳双键,羟基,还有____和 ____。
(2)反应②所需的试剂和条件是________。
(3)物质M的结构式____。
(4)⑤的反应类型是____。
(5)写出C到D的反应方程式_________。
(6)F的链状同分异构体还有____种(含顺反异构体),其中反式结构是____。
(7)设计由对苯二酚和丙酸制备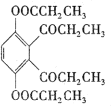 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
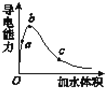
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com