
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:
实验方案:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______。
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______。
,写出第③步反应中铝元素转化的离子方程式______。
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______。
已沉淀完全的实验方法______。
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为__________,写出此方案下生成沉淀B的离子方程式______。
”应改为__________,写出此方案下生成沉淀B的离子方程式______。
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______。
,过滤后需要进行操作步骤是______。
(6)写出工业由氧化铝冶炼铝的化学方程式______。
【答案】过滤 漏斗 SiO2 ![]() 取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化 氨水或NH3
取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化 氨水或NH3 ![]() 洗涤沉淀、干燥
洗涤沉淀、干燥 ![]()
【解析】
由分离提纯流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,只有二氧化硅不与盐酸反应,沉淀A为![]() ,滤液A中为氯化铝、氯化铁、盐酸,则滤液A中加入过量NaOH,发生反应:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则沉淀B为
,滤液A中为氯化铝、氯化铁、盐酸,则滤液A中加入过量NaOH,发生反应:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则沉淀B为![]() ,滤液B中有
,滤液B中有![]() 、NaCl、NaOH,所以滤液B中的阴离子除了
、NaCl、NaOH,所以滤液B中的阴离子除了![]() 、
、![]() 外还有
外还有![]() ,通二氧化碳与
,通二氧化碳与![]() 反应生成氢氧化铝沉淀,最后加热Al(OH)3分解成氧化铝,以此来解答。
反应生成氢氧化铝沉淀,最后加热Al(OH)3分解成氧化铝,以此来解答。
(1)由上述分析可知,操作Ⅰ的名称是过滤,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有漏斗,
故答案为:过滤;漏斗;
(2)沉淀A为![]() ,第③步反应中铝元素转化的离子方程式为:
,第③步反应中铝元素转化的离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)证明滤液B中![]() 已沉淀完全的实验方法为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化,
已沉淀完全的实验方法为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化,
故答案为:取少量滤液B于试管中,滴加几滴KSCN溶液,振荡,溶液无明显变化;
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,滤液A含偏铝酸钠、硅酸钠,滤液B含氯化铝,沉淀B为硅酸,则“③过量CO2”应改为过量氨气或氨水,此方案下生成沉淀B的离子方程式为![]() ,
,
故答案为:过量氨气或氨水;![]() ;
;
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是洗涤沉淀、干燥,
,过滤后需要进行操作步骤是洗涤沉淀、干燥,
故答案为:洗涤沉淀、干燥;
(6)工业由氧化铝冶炼铝的化学方程式为:![]() ,
,
故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究H2还原Cu2O,设计装置如图:下列说法不正确的是( )
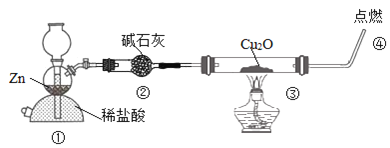
A.装置①也可用来制取CO2
B.装置②的作用之一是干燥氢气
C.通过③内固体颜色的变化判断反应是否完全
D.实验结束后,先熄灭酒精灯后停止通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
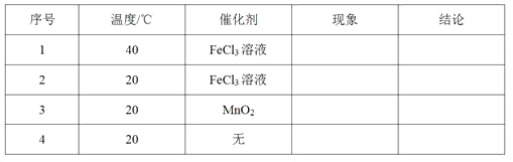
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
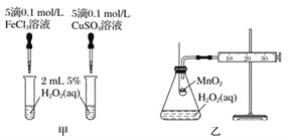
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.16g O3含有的氧原子数为NA
B.常温常压下,22.4L SO2含有的分子数为NA
C.1molMg变成Mg2+时,失去电子的数目为NA
D.1L 1mol·L-1H2SO4溶液中含H+的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:

(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成______.
可写成______.
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是______
为了加快该反应的反应速率,可采取的措施是______![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______,若继续加水稀释,平衡将______移动
______,若继续加水稀释,平衡将______移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和CuO在高温下反应可能生成Cu、![]() 、
、![]() 、CO。现将
、CO。现将![]() 碳粉跟
碳粉跟![]() 混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为
混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为![]() ,残余气体在标准状况下的体积为
,残余气体在标准状况下的体积为![]() 。下列说法不正确的是
。下列说法不正确的是
A.在硬质试管中隔绝空气高温加热固体混合物时,有![]() 碳参加了反应
碳参加了反应
B.试管中发生的所有氧化还原反应共转移电子![]()
C.反应后试管中剩余的固体混合物的总质量为![]()
D.反应生成铜和氧化亚铜的总物质的量为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com