
【题目】下列说法不正确的是( )
A.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取![]() 次的实验平均值等措施,以达到良好的实验效果
次的实验平均值等措施,以达到良好的实验效果
B.容量瓶、量筒和滴定管上都标有使用温度;量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
C.pH计能用于酸碱中和滴定终点的判断
D.在![]() 的
的![]() 溶液中滴加数滴
溶液中滴加数滴![]() 的NaOH溶液,溶液颜色从橙色变成黄色
的NaOH溶液,溶液颜色从橙色变成黄色
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=___。
(2)工业合成氨气的反应为N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是___。

其中表示平衡混合物中NH3的含量最高的一段时间是___。
(4)温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的化学平衡常数的为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g) ![]() 2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
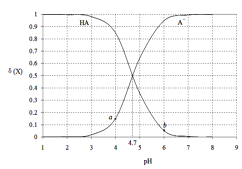
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2![]() N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
A. ②④ B. ③④ C. ③⑤ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) ![]() 2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
温度/体积分数/压强 | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | B |
915 | c | 75.0 | D |
1000 | E | f | 83.0 |
①b<f ②915 ℃、2.0 MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1 000 ℃)>K(810 ℃) 上述①~④中正确的 ( )
A.①②B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
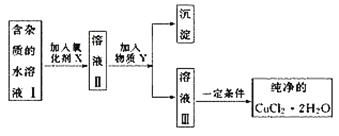
请回答下列问题:
(1)本实验最适合的氧化剂X是___(填序号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是____。
(3)本实验用加碱沉淀法能不能达到目的?___,原因是___。
(4)除去Fe3+的有关离子方程式是____。
(5)加氧化剂的目的是____。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体___,应如何操作___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com