


科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
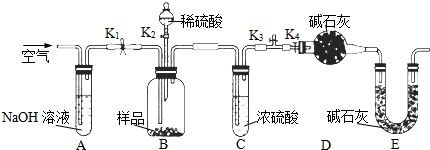
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
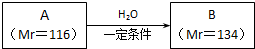
查看答案和解析>>
科目:高中化学 来源: 题型:
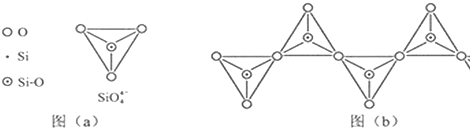
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、锌锰干电池中,锌电极是负极 |
| C、二次电池的化学反应是可逆反应 |
| D、氢氧燃料电池的产物为水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| C、汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一 |
| D、用聚氯乙烯代替聚乙烯作食品包装袋.有利于节约使用成本 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com