
| A、手机上用的锂离子电池属于二次电池 |
| B、锌锰干电池中,锌电极是负极 |
| C、二次电池的化学反应是可逆反应 |
| D、氢氧燃料电池的产物为水,属于环境友好电池 |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
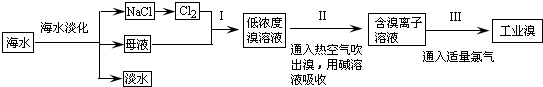
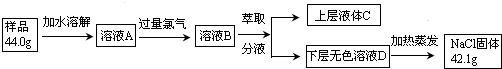
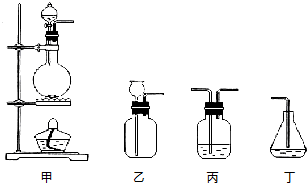
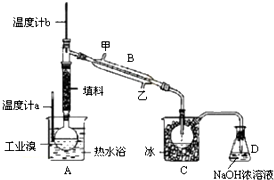
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸,实质上是电解水,故溶液酸性不变 |
| B、电解池内发生的反应均为自发进行的氧化还原反应 |
| C、电解硫酸钠溶液,在阴极和阳极上析出产物的物质的量之比为1:2 |
| D、电解氯化铜溶液,在阴极和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 mol?L-1 | K1=4.3×10-7 mol?L-1 K2=5.6×10-11 mol?L-1 | K1=9.1×10-8 mol?L-1 K2=1.1×10-12 mol?L-1 | K1=7.5×10-3 mol?L-1 K2=6.2×10-8 mol?L-1 K3=2.2×10-13 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com