
��������ƣ�Na2S2O3����ϡH2SO4��Һʱ�������·�Ӧ��
Na2S2O3+ H2SO4=Na2 SO4+SO2+S��+H2O ���з�Ӧ����������
A��0.1mol/L Na2S2O3��0.1mol/L H2SO4��Һ��5mL����ˮ5mL����Ӧ�¶�10��
B��0.1mol/L Na2S2O3��0.1mol/L H2SO4��Һ��5mL����ˮ10mL����Ӧ�¶�10��
C��0.1mol/L Na2S2O3��0.1mol/L H2SO4��Һ��5mL����ˮ10mL����Ӧ�¶�30��
D��0.2mol/L Na2S2O3��0.1mol/L H2SO4��Һ��5mL����ˮ10mL����Ӧ�¶�30��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ��һ��ѧ�����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
סլ���̳��ȵط������֣�������Ա�ø�ѹˮǹ���ˮ������е���Ҫ�����ǣ� ��
A�����Ϳ�ȼ����Ż�� B��ʹ�����������е�����
C�������¶ȵ�ȼ�����Ż������ D��ˮ�ֽ��������ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪�ֹ������и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A��Ħ�����߸�����������֮һ
B������٤��������û�е�λ��
C��������Ħ��������28g
D��1molH2OԼ����6��02��1023��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и߶��ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӦA(g)+3B(g) 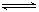 2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ����з�Ӧ����������
2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ����з�Ӧ����������
A����(D)=0.4 mol / ?L��s? B����(C)=0.5 mol / ?L��s?
C����(B)=0.6 mol / ?L��s? D����(A)=0.15 mol / ?L��s?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и߶��ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ȫȼ��һ����������ˮ�Ҵ����ų�������ΪQ��Ϊ��ȫ�������ɵ�CO2����ʹ֮��������Na2CO3�����ĵ�0.8mol��L NaOH��Һ500mL����ȼ��1mol�ƾ��ų���������
A�� 0.2Q B�� 0.1Q
C�� 5Q D�� 10Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и߶��ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A������Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
B���κη��ȷ�Ӧ�ڳ�������һ���ܷ�����Ӧ
C����Ӧ���������ֱ���е�����������Դ�С�����˷�Ӧ�Ƿ��ȷ�Ӧ�������ȷ�Ӧ
D������H��0ʱ������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�һ�ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ������
��һ����ɫ��ĩ������Ba(NO3)2��CaCl2��K2CO3�е�2�֡�Ϊȷ����ɷ֣���������ʵ�顣������Ͽ�Ƭ�е������ܽ��ԣ��Է�����
���Ͽ�Ƭ��һЩ���ʵ��ܽ���
| OH- | CO | Cl- | NO |
Na+ | �� | �� | �� | �� |
Ca2+ | | �� | �� | �� |
Ba2+ | �� | �� | �� | �� |
Mg2+ | �� | | �� | �� |
��1����������ɫ��ĩ��������ˮ�У����а�ɫ�������ɡ�
ͨ����������ɳ����ж�ԭ��ɫ��ĩ��һ�����е������� ���ѧʽ����
��2�����˵õ���1�����������İ�ɫ��������Һ��
ʵ�����н��й��˲���ʱ��ͨ����Ҫ���в��������е� ������ţ���
a. ������ b. ��ͨ©�� c. �ձ� d. ����ƿ
��3���ټ�������Һ�м���AgNO3��Һ����ϡ���ᣬ�����а�ɫ�������ɡ�
�ڣ�3����ʵ�鼰����˵����ԭ��ɫ��ĩ��һ�������е������� ���ѧʽ����������2���еİ�ɫ��������ϡ����ʱ��������Ӧ�Ļ�ѧ����ʽ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�һ�ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�ܹ�������Һ�ͽ���ķ�����
A������ B���۲���ɫ��״̬ C�����ö����ЧӦ D����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ʵ����
(12��)������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��ŨH2SO4������500 mL 0.2 mol��L��1��ϡH2SO4���ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� ��ҩ�� ����Ͳ ������ƿ ��������ƽ��
��ش��������⣺
��1�����������У�������ϡH2SO4ʱ�ò������� (�����)������ʱ��Ƿȱ�������� ��
��2�������㣬��ŨH2SO4�����Ϊ mL����ȷ��0.1����
��3�����ƹ��������²�����
A����Һ
B����ȡ
C��ϴ��
D������
E���ܽ�
F��ҡ��
����ȷ�IJ���˳��Ӧ�� (�����)��
��4�������ƹ����У�����������ȷ�����в����У����������ƫ�ߵ��� (�����)��
��ϴ����ȡŨH2SO4�����Ͳ������ϴ��Һת�Ƶ�����ƿ��
��ϡ�ͺ��H2SO4��Һδ����ȴ�����¾�ת�Ƶ�����ƿ��
�۶���ҡ�Ⱥ���Һ����ڱ��ߣ����ý�ͷ�ιܼ�����ˮ������
��ת��ǰ������ƿ�к�����������ˮ
�ݶ���ʱ�����ӱ���
��5������������ƿ����ȡ25.00mL��ϡ������Һ��100mL������ƿ����ˮϡ�����̶��ߡ�����������Һ��c��H+��= ��
��6��ij�о�С�������������Ͷ�������ͨ��ˮ��Һ�����Ʊ�100mL��0.4molH+����Һ����Ӧԭ����Cl2+SO2+2H2O= H2SO4+2HCl���������Ʊ��������������ģ��������״���µ����� L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com