
有一包白色粉末,含有Ba(NO3)2、CaCl2、K2CO3中的2种。为确定其成分,现做以下实验。结合资料卡片中的物质溶解性,试分析:
资料卡片:一些物质的溶解性
| OH- | CO | Cl- | NO |
Na+ | 溶 | 溶 | 溶 | 溶 |
Ca2+ | 微 | 不 | 溶 | 溶 |
Ba2+ | 溶 | 不 | 溶 | 溶 |
Mg2+ | 不 | 微 | 溶 | 溶 |
(1)将少量白色粉末加入足量水中,振荡,有白色沉淀生成。
通过上述现象可初步判断原白色粉末中一定含有的物质是 (填化学式)。
(2)过滤得到(1)中所产生的白色沉淀及滤液。
实验室中进行过滤操作时,通常需要下列玻璃仪器中的 (填序号)。
a. 玻璃棒 b. 普通漏斗 c. 烧杯 d. 容量瓶
(3)再继续向滤液中加入AgNO3溶液和过量稀硝酸,最终有白色沉淀生成。
第(3)步实验及现象说明,原白色粉末中一定还含有的物质是 (填化学式),若将(2)中的白色沉淀溶于稀硝酸时,发生反应的化学方程式是
。
(1)K2CO3(2)abc;(3)CaCl2 CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
【解析】
试题分析:(1)将白色粉末溶于水生成白色沉淀,沉淀为碳酸钡或碳酸钙,则一定含有碳酸钾,答案为K2CO3;(2)过滤时用到的玻璃仪器有漏斗、玻璃棒、烧杯;(3)向滤液中加入硝酸和硝酸银产生白色沉淀,说明滤液中含有氯离子,故一定含有的物质是CaCl2 ,则(2)中的白色沉淀为碳酸钙沉淀,碳酸钙和硝酸反应的方程式为 CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,答案为CaCl2 CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O.
考点:物质的检验


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:2014-2015学年吉林延边州汪清六中上第一次月考高一化学试卷(解析版) 题型:选择题
(3分)1mol?L﹣1硫酸溶液的含义是( )
A. 1L水中含有1mol硫酸 B. 1L溶液中含1mol H+
C.将98g硫酸溶于1L水所配成的溶液 D. 指1L硫酸溶液中含有98g H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高二上第一次质量检测化学试卷(解析版) 题型:填空题
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高二上第一次质量检测化学试卷(解析版) 题型:选择题
硫代硫酸钠(Na2S2O3)与稀H2SO4溶液时发生如下反应:
Na2S2O3+ H2SO4=Na2 SO4+SO2+S↓+H2O 下列反应速率最大的是
A.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃
B.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃
C.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃
D.0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高二上第一次质量检测化学试卷(解析版) 题型:选择题
下列设备工作时,将化学能转化为热能的是
A | B | C | D |
|
|
|
|
硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上第一次质量检测化学试卷(解析版) 题型:选择题
取物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,使之恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则该氯化物的化学式为( )
A.RCl B.RCl2 C.RCl3 D.RCl4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上第一次质量检测化学试卷(解析版) 题型:选择题
用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是
A.称量时,将固体NaOH直接放在天平左盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省玉溪市高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)下图是工业生产硝酸铵的流程。
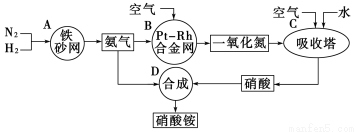
(1)吸收塔C中通入空气的目的是__________________ 。A、B、C、D四个容器中的反应,属于氧化还原反应的是________(填字母)。
(2)已知:4NH3(g)+3O2(g)===2N2(g) +6H2O(g) ΔH=-1266.8 kJ/mol
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:____________________________。
(3)已知:N2(g) +3H2(g)  2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3 : 1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省玉溪市高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.向某溶液中加入Ba(NO3)2溶液后产生白色沉淀,则原溶液中一定含有SO42-
B.向某稀溶液中加入Ba(NO3)2溶液后无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明一定是氯化物的溶液
C.将盛满H2的小试管管口向上靠近酒精灯火焰检验H2的纯度
D.将燃着的木条靠近导管口,木条熄灭,说明有CO2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com