
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。
【答案】把废镍催化剂粉碎(或适当加热、适当增大酸的浓度或提高搅拌速率等) 2Fe2++2H++H2O2=2Fe3++2H2O 5.0≤pH<6.8 Ni2++C2O42-+2H2O=NiC2O4·2H2O↓ 取适量上层清液于试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成 ![]()
【解析】
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,试剂a是一种绿色氧化剂,所以加入 的是H2O2将Fe2+氧化为Fe3+,加入Ni(HO)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca 2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,据此答题.
(1)根据影响化学反应速率的因素可知,提高浸出率,可把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等,故答案为:把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等;
(2)根据上面的分析可知,试剂a是H2O2,所以“氧化”时反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据表中的数据可知,pH为5.0时,Fe3+、Al3+沉淀完全,pH为6.8时Ni2+开始沉淀,所以pH的调控范围为5.0~6.8,故答案为:5.0≤pH<6.8;
(4)向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,“沉镍”时反应的离子方程式为Ni2++C2O42-+2H2O=NiC2O42H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成;当Ca2+沉淀完全时,即c(Ca2+)<10-5mol/L,根据Ksp(CaF2)=1.46×10-10,可知溶液中c(F-)>![]() mol/L,故答案为:Ni2++C2O42-+2H2O=NiC2O42H2O;取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成;
mol/L,故答案为:Ni2++C2O42-+2H2O=NiC2O42H2O;取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成;![]() 。
。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(s,石墨) = C(s,金刚石) ΔH=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa、25℃时,H2的燃烧热为ΔH= —285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(g) ΔH= —285.8kJ/mol
D.稀溶液中:H+(aq)+OH-(aq) = H2O(l) ΔH= —57.3kJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将![]() 和
和![]() 转化成难溶弱酸盐。
转化成难溶弱酸盐。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)将SrSO4转化成SrCO3的离子方程式为:_______________________________________,该反应的平衡常数表达式为_____________________________________;该反应能发生的原因是:________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将__________________________________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrSO4。实验所用的试剂为________;实验现象及其相应结论为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
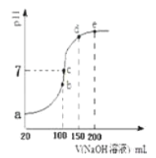
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.124gP4含有的P-P键的个数为6NA
B.S2Cl2 结构与过氧化氢相似,为非极性分子
C.O3、SO2、NH2-互为等电子体,空间构型都为V形
D.60gSiO2中含Si-O键的个数为2NA 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )

A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(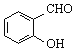 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com