
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )

A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
【答案】D
【解析】
A.选NaOH除去镁离子,选氯化钡除去硫酸根离子,选碳酸钠除去钙离子及过量的钡离子,过滤后加盐酸至中性;
B.电解饱和食盐水可生成NaOH、氢气、氯气;
C.加热促进镁离子水解,且生成盐酸易挥发,HCl可抑制水解;
D.步骤④中Br元素的化合价升高、⑤中Br元素的化合价降低、⑥中Br元素的化合价升高。
![]() 选NaOH除去镁离子,选氯化钡除去硫酸根离子,选碳酸钠除去钙离子及过量的钡离子,过滤后加盐酸至中性,则步骤①中所加试剂及相关操作顺序可以是过量NaOH溶液
选NaOH除去镁离子,选氯化钡除去硫酸根离子,选碳酸钠除去钙离子及过量的钡离子,过滤后加盐酸至中性,则步骤①中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸,故A正确;
盐酸,故A正确;
B. 电解饱和食盐水可生成NaOH、氢气、氯气,步骤②的反应原理为![]()
![]()
![]() ,故B正确;
,故B正确;
C. 加热促进镁离子水解,且生成盐酸易挥发,HCl可抑制水解,则步骤③中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]() ,故C正确;
,故C正确;
D. 步骤④中Br元素的化合价升高、⑤中Br元素的化合价降低、⑥中Br元素的化合价升高,则步骤④、⑥中溴元素均发生氧化反应,⑤中溴元素被还原,故D错误;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25 mL0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与CH3COOH 溶液体积关系如图所示。下列有关粒子浓度关系正确的是

A. 曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法不正确的是![]()
A.“地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油
B.白铁![]() 镀锌铁板
镀锌铁板![]() 比马口铁
比马口铁![]() 镀锡铁板
镀锡铁板![]() 更耐腐蚀
更耐腐蚀
C.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
D.![]() 的燃烧热是
的燃烧热是![]() ,则
,则![]() 反应的H=+2×283.0kJ/mol
反应的H=+2×283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
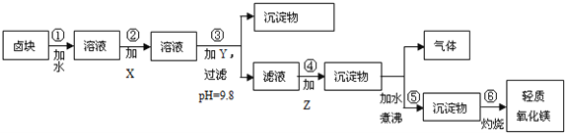
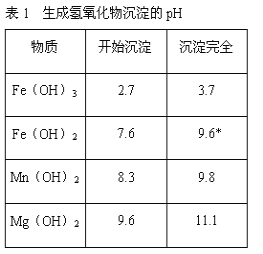
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
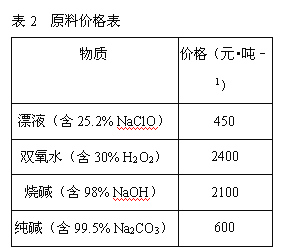
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置进行相应实验,有关说法不正确的是
A.图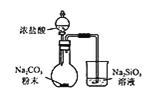 装置可验证酸性:
装置可验证酸性:![]()
B.图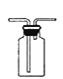 装置可用于收集气体
装置可用于收集气体![]()
C.图![]() 装置可用于分离
装置可用于分离![]() 萃取碘水后的有机层和水层
萃取碘水后的有机层和水层
D.图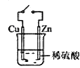 装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com