
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
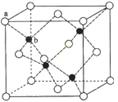
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的分子量为
A.28 B.60 C.32 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用来判断醋酸属于弱电解质的实验事实是
A.向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色
B.向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色
C.通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱
D.取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 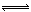 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为
mol•L-1•s-1;反应的平衡常数K1= mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T 100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2= mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向 (填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
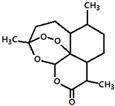
2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。下图是青蒿素的结构,则有关青蒿素的说法中不正确的是:
A.青蒿素分子式为C15H22O5
B.青蒿素有—O—O—键具有较强的氧化性
C.青蒿素易溶于水、乙醇、苯
D.青蒿素在碱性条件下易发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
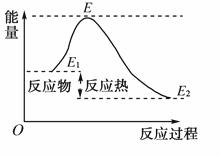
A.反应物分子间的有效碰撞是反应的先决条件
B.反应物的分子的每次碰撞都能发生化学反应
C.活化分子具有比普通分子更高的能量
D.如图所示正反应的活化能为E-E 1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,
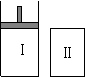 在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,
在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,
发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)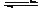 aZ(g)。
aZ(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.a为2
D.平衡时Ⅰ容器的体积小于V L
查看答案和解析>>
科目:高中化学 来源: 题型:
测定稀硫酸和稀氢氧化钠中和热的实验装
置如右图所示.
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):
__________________________________________;
(2) 装置图中碎泡沫塑料所起作用为: ;
(3) ①取50 mL NaOH溶液和30 mL硫酸溶液进行实验,
实验数据如下表.请填写下表中的空白:
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
②若上述实验所测中和热数值偏小,产生偏差的原因可能是( )
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)⇌nY(g);△H=Q kJ/mol.反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| /L积体气温体c(Y)/mol•L﹣1度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是( )
|
| A. | m>n |
|
| B. | Q<0 |
|
| C. | 温度不变,压强增大,Y的质量分数减少 |
|
| D. | 体积不变,温度升高,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com