
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计实验制备亚氯酸钠![]() 并对其性质进行研究。
并对其性质进行研究。
实验Ⅰ:制取![]()
利用如图所示装置进行实验。

![]() 仪器a的名称是________,其作用是________。
仪器a的名称是________,其作用是________。
![]() 装置
装置![]() 发生的反应中氧化剂和还原剂的物质的量之比为________。
发生的反应中氧化剂和还原剂的物质的量之比为________。
![]() 装置
装置![]() 中制备
中制备![]() 的离子方程式为________。
的离子方程式为________。
![]() 用电解
用电解![]() 和
和![]() 的混合溶液也可以制备
的混合溶液也可以制备![]() ,阴极的电极反应式为________。
,阴极的电极反应式为________。
实验Ⅱ:研究![]() 的性质
的性质
![]() 利用所提供的试剂
利用所提供的试剂![]() 样品、
样品、![]() 溶液、KI溶液、稀硫酸、稀硝酸
溶液、KI溶液、稀硫酸、稀硝酸![]() 验证
验证![]() 的氧化性,并测定
的氧化性,并测定![]() 样品的纯度。
样品的纯度。
![]() 准确称取所得
准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成
于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成![]() 待测溶液。
待测溶液。
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用![]() 标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为
标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为![]() 已知:
已知:![]() 。该样品中
。该样品中![]() 的质量分数为________
的质量分数为________![]() 保留一位小数
保留一位小数![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体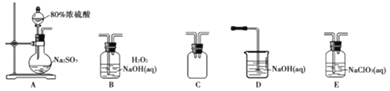
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )

A.a和b用导线连接时,铁电极上发生还原反应
B.a和b用导线连接时,电子经硫酸铜溶液从铁电极流向铜电极
C.无论a和b是否连接,铜电极质量都增加
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
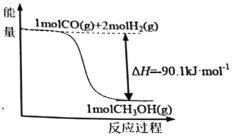
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO42H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S、FeS2)回收Mo并制备钼酸钠晶体,其主要流程如图所示:
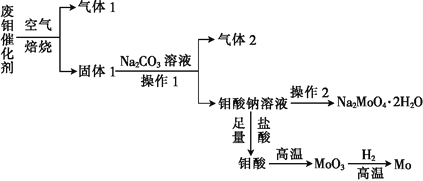
回答下列问题:
(1)可以提高焙烧效率的措施有__________________(填一条即可)。MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若生成0.1molMoO3,则反应中转移电子的数目为______。
(2)往固体1中加碳酸钠溶液,发生反应的化学方程式为_______________。
(3)操作2为______________、洗涤、干燥。
(4)制备钼酸钠晶体还可通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中还有硫酸钠生成,则反应的离子方程式为___________。
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的体积变化]。
(6)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com