
【题目】某化学兴趣小组同学设计实验制备亚氯酸钠![]() 并对其性质进行研究。
并对其性质进行研究。
实验Ⅰ:制取![]()
利用如图所示装置进行实验。

![]() 仪器a的名称是________,其作用是________。
仪器a的名称是________,其作用是________。
![]() 装置
装置![]() 发生的反应中氧化剂和还原剂的物质的量之比为________。
发生的反应中氧化剂和还原剂的物质的量之比为________。
![]() 装置
装置![]() 中制备
中制备![]() 的离子方程式为________。
的离子方程式为________。
![]() 用电解
用电解![]() 和
和![]() 的混合溶液也可以制备
的混合溶液也可以制备![]() ,阴极的电极反应式为________。
,阴极的电极反应式为________。
实验Ⅱ:研究![]() 的性质
的性质
![]() 利用所提供的试剂
利用所提供的试剂![]() 样品、
样品、![]() 溶液、KI溶液、稀硫酸、稀硝酸
溶液、KI溶液、稀硫酸、稀硝酸![]() 验证
验证![]() 的氧化性,并测定
的氧化性,并测定![]() 样品的纯度。
样品的纯度。
![]() 准确称取所得
准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成
于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成![]() 待测溶液。
待测溶液。
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用![]() 标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为
标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为![]() 已知:
已知:![]() 。该样品中
。该样品中![]() 的质量分数为________
的质量分数为________![]() 保留一位小数
保留一位小数![]() 。
。
【答案】干燥管 防止倒吸 ![]()
![]()
![]()
![]() 溶液 稀硫酸
溶液 稀硫酸 ![]()
![]() 。
。
【解析】
⑴看图得出仪器a的名称,其作用是防止倒吸。
⑵在酸性条件下,![]() 被
被![]() 还原为
还原为![]() ,化合价降低1价,
,化合价降低1价,![]() 被
被![]() 氧化为
氧化为![]() ,化合价升高2价。
,化合价升高2价。
⑶在碱性条件下,![]() 被
被![]() 还原为
还原为![]() ,
,![]() 被
被![]() 氧化为
氧化为![]() ,得出离子方程式。
,得出离子方程式。
⑷电解时,![]() 在阴极得到电子生成
在阴极得到电子生成![]() ,写出电极反应式。
,写出电极反应式。
⑸①根据题意知:准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,写出反应的离子方程式。
于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,写出反应的离子方程式。
![]() 根据方程式建立关系式,再建立等式进行计算。
根据方程式建立关系式,再建立等式进行计算。
⑴仪器a的名称是干燥管,作用是防止倒吸,故答案为:干燥管;防止倒吸;
⑵在酸性条件下,![]() 被
被![]() 还原为
还原为![]() ,化合价降低1价,
,化合价降低1价,![]() 被
被![]() 氧化为
氧化为![]() ,化合价升高2价,故装置
,化合价升高2价,故装置![]() 中氧化剂和还原剂的物质的量之比为
中氧化剂和还原剂的物质的量之比为![]() ,故答案为:
,故答案为:![]() 。
。
⑶在碱性条件下,![]() 被
被![]() 还原为
还原为![]() ,
,![]() 被
被![]() 氧化为
氧化为![]() ,装置
,装置![]() 中制备
中制备![]() 的离子方程式为
的离子方程式为![]() ,故答案为:
,故答案为:![]() 。
。
⑷电解时,![]() 在阴极得到电子生成
在阴极得到电子生成![]() ,其电极反应式为
,其电极反应式为![]() ,故答案为:
,故答案为:![]() 。
。
⑸①根据题意知:准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,充分反应,反应的离子方程式为
于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,充分反应,反应的离子方程式为![]() ,故答案为:KI溶液;稀硫酸;
,故答案为:KI溶液;稀硫酸;![]() 。
。
![]() 根据方程式
根据方程式![]() 、
、![]() ,
,
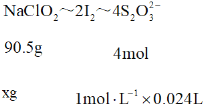
90.5g:xg = 4mol: ![]()
解得x = 0.543g,所以样品中![]() 的质量分数为
的质量分数为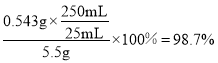 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列叙述正确的是
A.0.5 mol Mg在空气中完全燃烧生成MgO和Mg3N2时,转移的电子数为NA
B.7.8 g Na2O2与足量水反应时,转移的电子数为0.2NA
C.64 g CaC2固体中所含的阴、阳离子总数为3NA
D.密闭容器中充入1 mol H2与1 mol I2反应制备HI时,生成H-I键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为_________。终点时消耗标准溶液25mL,硝酸银样品纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)具有优良的还原性,在有机化学和无机化学领域有着广泛的应用。利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等![]() 制取NaBH4的流程如图:
制取NaBH4的流程如图:

已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在,回答下列问题:
(1)写出加快硼精矿溶解速率的措施______![]() 写一种
写一种![]() 。
。
(2)操作1为______,滤渣主要成分为______。
(3)除硅铝步骤加入CaO而不加入CaCl2的原因有:①能将硅、铝以沉淀除去;②______.
(4)氢化镁(MgH2)中H元素的化合价为______;MgH2与NaBO2在一定条件下发生反应1,其化学方程式为:______。
(5)如图在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式______。
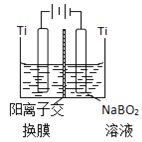
(6)硼氢化钠是一种强还原剂,碱性条件可处理电镀废液中的硫酸铜制得纳米铜,从而变废为宝,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室常用如图所示装置制取少量溴苯,请回答下列问题。
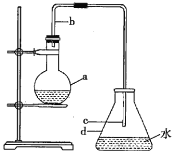
(1)烧瓶a中盛装的试剂是苯、液溴和铁屑。导管b的作用有两个:一是导气,二是起________的作用。
(2)反应过程中在导管c的下口附近可以观察到有白雾出现,这是由于反应生成的________(填化学式)遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入![]() 溶液,有________生成。
溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯中,可以观察到烧杯底部有棕色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂________________除去溴。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表![]() 不考虑生成N2O4)
不考虑生成N2O4)
0 | 10 | 20 | 30 | 40 | 50 | |
实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是( )
A.实验2比实验1的反应容器内压强减小
B.实验2比实验l使用了效率更高的催化剂
C.实验1比实验3的平衡常数大
D.实验2和实验3可判断该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠![]() 常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品
常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品![]() 只含
只含![]() 和
和![]() 的纯度,某小组设计如下两种实验方案:
的纯度,某小组设计如下两种实验方案:
实验原理:![]() 也可以用盐酸与过碳酸钠反应
也可以用盐酸与过碳酸钠反应![]() 。
。
方案1:液吸法。取![]() 样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬
样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬![]() 溶液作
溶液作![]() 的吸收剂。
的吸收剂。
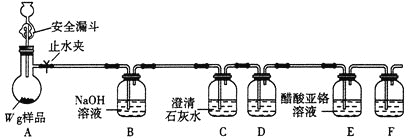
⑴安全漏斗中“安全”的含义是____________________________。
⑵装置C的作用是__________;装置D和F盛放同一种试剂,可能是________(填名称)。
⑶本实验通过装置________________(填字母)实验前后质量差可测定![]() 的质量。
的质量。
⑷实验装置气密性良好及装置内试剂足量,但实验发现测定的样品纯度总是偏低,其主要原因可能是________________________。
方案2:量气法。实验装置如图所示。
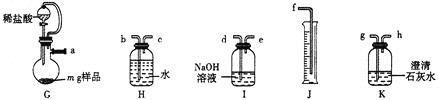
⑸气流方向由左至右,则导管口连接顺序为![]() ________
________![]() 。
。
⑹实验时向烧瓶内加入足量稀盐酸,实验完毕后,在室温下,测得J中水的体积为![]() 。已知室温下,气体摩尔体积为
。已知室温下,气体摩尔体积为![]() 。该样品纯度为__________%(用含x、y、m的代数式表示)。若其他操作都合理,读数时J中液面高于H中液面,则测得结果________(填“偏高”“偏低”或“无影响”)。
。该样品纯度为__________%(用含x、y、m的代数式表示)。若其他操作都合理,读数时J中液面高于H中液面,则测得结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A.某温度时的混合溶液中c(H+) =![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C.常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
D.常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com