
 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Cu与浓H2SO4共热 |
| B、红热的木炭与浓H2SO4反应 |
| C、Na2SO3与浓H2SO4反应 |
| D、S在空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b<2 a |
| B、C2<2 C1 |
| C、C2>2 C1 |
| D、C1=2 C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
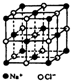 【化学--进修3:物质结构与性质】
【化学--进修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com