
����Ŀ����֪NH4Cl��Һ�д�������ƽ�⣺NH4+��aq��+H2O��l��![]() NH3��H2O��aq��+H+��aq������H>0���ش��������⣺
NH3��H2O��aq��+H+��aq������H>0���ش��������⣺
��1������Һ�м���Zn�ۣ�ƽ��___�ƶ�(����������������������������)�����ܳ��ֵ�������__��
��2�������¶ȣ�H+��Ũ��___������������������С����������������ƽ��___�ƶ�(����������������������������)��
��3������ѹǿ��ƽ��___�ƶ�(����������������������������)����Ӧ����___������������������С����������������
��4���÷�Ӧƽ�ⳣ���ı���ʽΪ___�������¶Ȳ����ټ���NH4Cl(aq)��ƽ�ⳣ��___������������������С����������������
���𰸡����� п���ܽ⣬�������� ���� ���� �� ���� ![]() ����
����
��������
NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�����Ӱ�컯ѧƽ������ط������
NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�����Ӱ�컯ѧƽ������ط������
(1)����Һ�м���Zn�ۣ�п�������ӷ�Ӧ�ų�������������Ũ�ȼ�С��ƽ�������ƶ����ʴ�Ϊ������п���ܽ⣬�������ݣ�
(2)NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���H+��Ũ�����ʴ�Ϊ����������
NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���H+��Ũ�����ʴ�Ϊ����������
(3)�÷�Ӧ����Һ�н��У�����ѹǿ��ƽ�ⲻ�ƶ�����Ӧ���ʲ��䣬�ʴ�Ϊ���������䣻
(4)NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0����Ӧ��ƽ�ⳣ���ı���ʽΪ
NH3��H2O(aq)+H+(aq)����H>0����Ӧ��ƽ�ⳣ���ı���ʽΪ![]() ���¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴ�Ϊ��
���¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴ�Ϊ��![]() �����䡣
�����䡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯������������;��������ʵ��������������ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | -85.5 | 115.2 | ��600(�ֽ�) | -75.5 | 16.8 | 10.3 |
�е�/�� | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Feԭ�Ӽ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ____________����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____________�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���____________��
��3��ͼ��a��ΪS2�Ľṹ�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ____________��
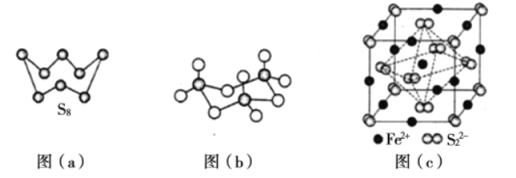
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ____________�Σ����й��ۼ���������____________�֣��������������д�����ͼ��b����ʾ�����۷��ӡ��÷�����Sԭ�ӵ��ӻ��������Ϊ____________��
��5�� FeS2����ľ�����ͼ��c����ʾ�������߳�Ϊa nm�� FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____________g��cm��3��������Fe2+λ��S22�����γɵİ���������ģ�����������ı߳�Ϊ____________nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��![]() �ں��������н��У��ﵽƽ��״̬�ı�־��( )
�ں��������н��У��ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������![]() ��ͬʱ����
��ͬʱ����![]()
�ڵ�λʱ��������![]() ��ͬʱ����
��ͬʱ����![]()
����![]() ��
��![]() ��
��![]() �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ2��2��1��״̬
�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ2��2��1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ƽ����Է����������ٸı��״̬
A.�٢ܢ�B.�ڢۢ�C.�٢ۢ�D.�٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2��H2�ڴ�������ϳɰ��������̼������仯��ʾ��ͼ��ͼ��ʾ����![]() ����
����![]() �ֱ��ʾN2��H2��NH3������˵����ȷ����( )
�ֱ��ʾN2��H2��NH3������˵����ȷ����( )
![]()

A.ʹ�ô���ʱ���ϳɰ��ķ�Ӧ�ų�����������
B.�ڸù����У�N2��H2 �ϼ��γ� N ԭ�Ӻ� H ԭ��
C.�ڸù����У�Nԭ�Ӻ�Hԭ���γ��˺��зǼ��Լ���NH3
D.�ϳɰ���Ӧ�У���Ӧ��ϼ����յ����������������γ��¼��ͷŵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������״����������ȫ����Ĺ�ע�����ⶥ��ҽѧ�ڿ�����Ӣ����ҽѧ��־���� 2020��1��31�ű����ƣ�������������״����(2019-nCoV)��Ⱦ���ߣ���סԺ��7�쿪ʼʹ��ҩ��Remdesivir(�����Τ)���ƣ������ƺ���֢״��ʧ�����Լ��ᣬ�������Ժ�ת��Remdesivir(�����Τ)�ij�������Ч���������ҹ��ĸ߶����ӡ������м��� K �Ǻϳɸ�ҩ��Ĺؼ��м��塣
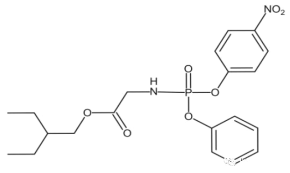
ҩ�������Τ(Remdesivir))��2019������״����(2019-nCoV)�������������ã�KΪҩ��ϳɵ��м��壬��ϳ�·�����£�
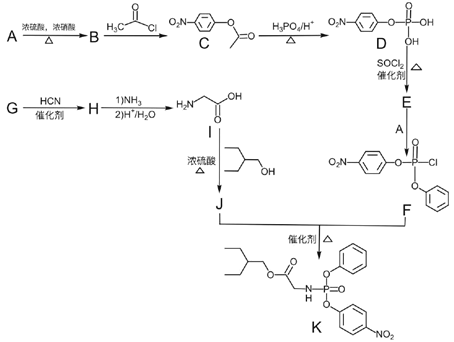
��֪��
��.R��OH![]() R��Cl
R��Cl
��. ![]()
![]()
![]()
![]()
![]()
![]()
![]()
�ش��������⣺
(1)B�Ļ�ѧ����Ϊ______________��
(2)J�к��������ŵ�����Ϊ________��
(3)B��C�ķ�Ӧ����__________��
(4)��G���� H �Ļ�ѧ��Ӧ����ʽΪ_______��
(5)E�к�����Clԭ�ӣ��� E �Ľṹ��ʽ______________��
(6)X��Cͬ���칹�壬д����������������X�Ľṹ��ʽ__________
�ٱ����Ϻ��������ұ�����ֻ��һ����ԭ��
���� FeCl3��Һ������ɫ��Ӧ
��1mol �� X ���������� Na ��Ӧ������ 2g H2
(7)����ɱ��״�Ϊԭ���Ʊ�������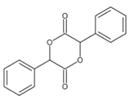 �ĺϳ�·��__________ (���Լ���ѡ)��
�ĺϳ�·��__________ (���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ�ĵ绯ѧװ�ô�����ҵβ���е������ʵ����Ԫ�صĻ��ա�����˵������ȷ����
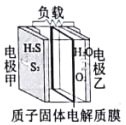
A. ��ع���ʱ�����ɵ��Ƹߵĵ缫����������Ƶ͵ĵ缫���ƶ�
B. ��ع���һ��ʱ�������������O2��H2S��������
C. ����1molH2S���뷴Ӧ������2molH+�ɸ���������������
D. �缫���ϵĵ缫��ӦΪ��2H2S+4OH�D�D4e��=S2+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ת��Ϊ
ת��Ϊ![]() �ķ���Ϊ��������
�ķ���Ϊ��������
A.��������NaOH��Һ���Ⱥ���ͨ��CO2
B.��Һ���ȣ�ͨ��������HCl
C.��ϡH2SO4���Ⱥ���������Na2CO3
D.��ϡH2SO4���Ⱥ���������NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��![]() H��
H��![]() H��
H��![]() H��
H��![]() Mg��
Mg��![]() Mg��
Mg��![]() Cu�й���____��Ԫ�أ�_____��ԭ�ӡ�
Cu�й���____��Ԫ�أ�_____��ԭ�ӡ�
(2)�����и������ʣ�A.O2��O3 B.12C��13C C.CH3��CH2��CH2��CH3��![]() D.
D.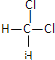 ��
��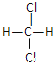 E.������顣
E.������顣
��_________�������ʻ�Ϊͬλ�ء�
��__________�������ʻ�Ϊͬ�������塣
��_________������������ͬϵ�
��_________�������ʻ�Ϊͬ���칹�塣
��_________������������ͬһ���ʡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com