
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为___,基态氮原子最高能级上电子自旋方向均相同,这是由____规则(原理)确定的,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)H2O、CO2、NH3三种分子中,中心原子的杂化轨道类型为sp的是___,属于V形分子的是____。在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_____。
(3)要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是___,下列事实不能支持Na2CO3的晶体类型为离子晶体的是___(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO32-
c.可溶于水 d.晶体中存在离子键,共价键
(4)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示(图中微粒表示相应的结构微粒),则该氧化物的化学式为___,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=___(用含d、
,则阿伏加德罗常数NA=___(用含d、![]() 的代数式表示)。
的代数式表示)。

【答案】1s22s22p63s23p5或[Ne]3s23p5 洪特 N>O>C CO2 H2O CO2是非极性分子而水是极性分子,故CO2在水中溶解度较小,NH3是极性分子且能与水分子形成分子间氢键,故NH3在水中溶解度很大 X-射线衍射法 c Na2O ![]()
【解析】
(1)核外电子排布满足能量最低原理、泡利不相容原理;N原子2p轨道上的电子处于半充满状态,第一电离能大于O;
(2)根据价电子对数判断中心原子的杂化轨道类型;利用价电子互斥理论判断分子空间构型。分子间形成氢键可以增大溶解度,极性分子易溶于极性溶剂;
(3)X-射线衍射法可以判断晶体和非晶体;溶解性与晶体类型无关。
(1)氯原子核外有17个电子,根据能量最低原理,基态氯原子的电子排布式为1s22s22p63s23p5,电子在同一能级上自旋方向相同是由洪特规则确定的。N原子2p轨道上的电子处于半充满状态,第一电离能大于O,元素的第一电离能由大到小的顺序为N>O>C。
(2)H2O、CO2、NH3三种分子中,中心原子的价层电子对数分别为![]() 4个、
4个、![]() 2个、
2个、![]() 4个,故中心原子杂化轨道类型分别为sp3、sp、sp3。水分子是V形分子。NH3可与水分子间形成氢键,从而使其溶解度很大;CO2是非极性分子而水是极性分子,故CO2在水中溶解度小。
4个,故中心原子杂化轨道类型分别为sp3、sp、sp3。水分子是V形分子。NH3可与水分子间形成氢键,从而使其溶解度很大;CO2是非极性分子而水是极性分子,故CO2在水中溶解度小。
(3)判断固体是晶体还是非晶体最可靠的方法是X-射线衍射法。离子晶体熔点较高,由离子构成,含有离子键,由于许多分子晶体也可溶于水,故c项符合题意。
(4)由图及均摊原理知,晶胞中氧离子数是![]() 、钠离子的数目是8,故化学式为Na2O,一个晶胞中含有4个“Na2O”组成微粒,晶胞的体积为d3
、钠离子的数目是8,故化学式为Na2O,一个晶胞中含有4个“Na2O”组成微粒,晶胞的体积为d3![]() 10-30 cm3,晶胞的质量为
10-30 cm3,晶胞的质量为![]() ,
,![]() ,
,![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24 LCH3OH中含有的原子数目为6 NA
B. 18 g 2H2O中含有的电子数目为10 NA
C. 25℃时,1 L pH=13的Ba(OH)2溶液中含有OH-数为0.05 NA
D. 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)葡萄糖的结构简式为__________,B分子中的官能团名称为_______。
(2)反应⑦中物质X的分子式为_________,反应⑧的类型为_________。
(3)反应③的化学方程式为_______。
(4)反应⑤的化学方程式为_________。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是______。
(5)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为_____。
(6)检验反应①进行程度,需要的试剂有________。
A 新制的Cu(OH)2悬浊液 B 碘水
C NaOH溶液 D FeCl3溶液
(7)乙烯的同系物丙烯(CH2=CH-CH3)可以通过加聚反应生成高分子化合物,其结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lgc(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是( )
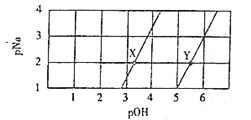
A. X点所在的直线表示NaHA溶液的稀释
B. 在Y点加入适量NaOH固体可以达到X点
C. 将X和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 常温下,H2A的Ka1数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
则表示甲烷燃烧热的热化学方程式____________________________________________。
(2)氢气、甲烷、甲醇是优质的清洁燃料,可制作燃料电池。
某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是___________(填序号)

A.电源中的a一定为正极,b一定为负极
B.不能用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++ 2e-= H2↑
(3)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)

①一定条件下CH4的平衡转化率与温度、压强的关系如图,则Pl_________P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为___________(填“<”、“>”“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为10L的反应室,反应达平衡的标志是:_______
a.容器的压强恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器内气体密度恒定
d.3v(CH4)=v(H2)
e. 容器内气体平均相对分子质量恒定
③如果将1mol CH4和2mol H2O通入容积为10L的反应室达到平衡时CH4的转化率为50%,则100℃时该反应的平衡常数K=___________。
(4)已知2H2(g)+CO(g)![]() CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
(5)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,
①负极的电极反应式为___________,
②用该原电池做电源,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH=___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:

(1)压强P1比P2 (填大或小);
(2)(a+b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);
(4)正反应为 (填吸热或放热)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
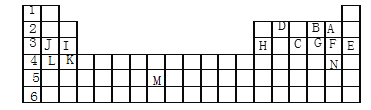
(1)表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是___________,非金属性最强的是___________,常温下单质为液态的非金属元素是_________,属于过渡元素的是______________(该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为______________,其中以___________最不稳定。
(3)第三周期中原子半径最小的是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com