
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
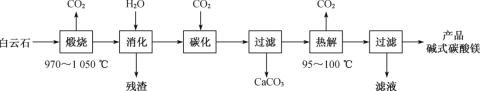
(1)“煅烧”时发生主要反应的化学方程式为___。
(2)常温常压下,“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
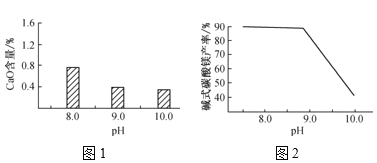
①应控制“碳化”终点pH约为___,钙元素的主要存在形式是___(填化学式)。
②根据图2,当pH=10.0时,镁元素的主要存在形式是___(填化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为___。
(4)该工艺为达到清洁生产,可以循环利用的物质是___(填化学式)。
【答案】CaMg(CO3)2![]() CaO+MgO+2CO2↑ 9.0 CaCO3 Mg(OH)2 5Mg(HCO3)2
CaO+MgO+2CO2↑ 9.0 CaCO3 Mg(OH)2 5Mg(HCO3)2![]() 4MgCO3·Mg(OH)2·4H2O↓+6CO2↑ CO2
4MgCO3·Mg(OH)2·4H2O↓+6CO2↑ CO2
【解析】
白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]在高温下焙烧,其中CaMg(CO3)2分解生成CaO、MgO和CO2,再加水“消化”,其中MgO、CaO均与水反应生成Mg(OH)2和Ca(OH)2,经过滤除去SiO2、Fe2O3等残渣,再向所得溶液中通入CO2气体进行碳化,使得Mg(OH)2转化为可溶的Mg(HCO3)2,经过滤除去CaCO3,将所得Mg(HCO3)2溶液加热并控制温度95100![]() 即得到碱式碳酸镁,最后过滤并洗涤得到产品,据此分析作答;
即得到碱式碳酸镁,最后过滤并洗涤得到产品,据此分析作答;
(1) CaMg(CO3)2的煅烧分解类似于CaCO3、MgCO3 的高温分解,CaMg(CO3)2![]() CaO+MgO+2CO2↑;
CaO+MgO+2CO2↑;
(2) ①由图象可知,应控制“碳化”终点pH约为9.0,这时碱式碳酸镁产率较高,而CaO含量较低;煅烧产物CaO和MgO都可与水反应生成Ca(OH)2和Mg(OH)2,结合产物的要求,所以“碳化”时发生的主要反应有Mg(OH)2+2CO2=Mg(HCO3)2 和Ca(OH)2+CO2= CaCO3↓+H2O,钙元素存在的主要形式为CaCO3,故答案为:9.0;CaCO3;
②当pH= 10.0时,镁元素的主要存在形式是Mg(OH)2;
(3)由Mg(HCO3)2受热分解生成碱式碳酸镁的化学方程式为5Mg(HCO3)2 ![]() 4MgCO3·Mg(OH)2 ·4H2O↓+6CO2↑;
4MgCO3·Mg(OH)2 ·4H2O↓+6CO2↑;
(4)由流程图可知,可循环利用的物质有CO2。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温、同浓度时,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三个平衡体系(不考虑亚硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中离子浓度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都减小,可行的方法是________________。
A 加入过量CaO(s) B 加入少量NaOH(s) C 通入过量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“碱”或“中”),其电荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的离子方程式为:___________。
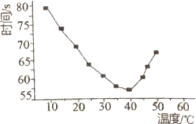
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,写出该反应的离子方程式:___________。
【6】将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示,下列说法正确的是( )

A. 铝球表面有气泡产生,溶液中有白色沉淀生成;杠杆不平衡
B. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出;溶液蓝色变浅,杠杆右边下沉
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO2和NH3为原料合成尿素。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=-159.47 kJ·mol-1
NH2CO2NH4(s) ΔH1=-159.47 kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g) ΔH3
CO(NH2)2(s)+H2O(g) ΔH3
回答下列问题:
(1)在相同条件下,反应Ⅰ分别在恒温恒容容器中和绝热恒容容器中进行,二者均达到平衡后,c(CO2)恒温________c(CO2)绝热(填“大于”“小于”或“等于”);ΔH3=____________。
(2)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4 mol NH3和0.2 mol CO2放入容积为2 L的密闭容器中,t1时达到化学平衡,c(CO2)随时间t变化曲线如图甲所示,在0~t1时间内该化学反应速率υ(NH3)=____________;若其他条件不变,t1时将容器体积压缩到1 L,t2时达到新的平衡。请在图甲中画出t1~t2时间内c(CO2)随时间t变化的曲线。___________________________________
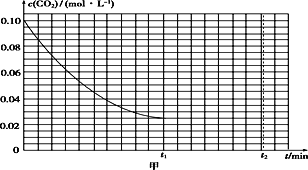
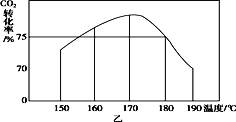
(3)在150 ℃时,将2 mol NH3和1 mol CO2置于a L 密闭容器中,发生反应Ⅲ,在t时刻,测得容器中CO2转化率约为73%,然后分别在温度为160 ℃、170 ℃、180 ℃、190 ℃时,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线(见图乙)。在150~170 ℃之间,CO2转化率呈现逐渐增大的变化趋势,其原因是__________180 ℃时反应Ⅲ的平衡常数K=____________(用含a的式子表示)。
(4)侯氏制碱法主要原料为NaCl、CO2和NH3,其主要副产品为NH4Cl,已知常温下,NH3·H2O的电离常数Kb=1.8×10-5,则0.2 mol·L-1 NH4Cl溶液的pH约为________(取近似整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
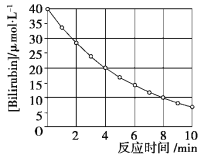
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
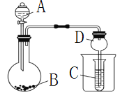
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置,并用单线桥法标明电子转移的方向和数目。________________
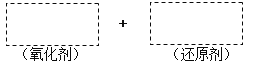
(2)生成2 mol的HIO3转移的电子数为___________
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成I的是_____(选填序号)
a.盐酸 b.硫化氢 c.溴化钠 d.硫酸亚铁
(4)若向H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,2H2(g)+O2(g)![]() 2H2O(l)+566kJ。下列说法错误的是
2H2O(l)+566kJ。下列说法错误的是
A.H2![]() H+H的过程需要吸热
H+H的过程需要吸热
B.若生成2mol水蒸气,则放出的热量大于566kJ
C.2g氢气完全燃烧生成液态水所释放的能量为283kJ
D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com