
【题目】某校化学学习小组利用如图装置来制取乙酸乙酯。
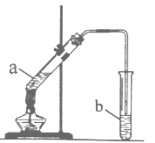
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。
II. 已知化学方程式:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)试管a中加入碎瓷片,其作用是_____(填字母代号)。
A.加快化学反应速率 B.防止溶液暴沸
(2)试管b中的溶液是_____(填字母代号)。
A饱和碳酸钠溶液 B.饱和氢氧化钠溶液
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层。
①乙酸乙酯在________(填“上层”或“下层”)。
②常用________操作将两层液体分离(填“过滤”或“分液”)。
(4)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)。
【答案】B A 上层 分液 1.85
【解析】
根据实验室制备乙酸乙酯的实验原理及装置分析解答;根据关系式计算产物的质量。
(1)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,故答案为:B;
(2)试管b中的溶液是饱和Na2CO3溶液,用于中和乙酸,溶解乙醇,降低乙酸乙酯在水中的溶解度,故答案为:A;
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层,乙酸乙酯密度比水小,在上层,常用分液操作将两层液体分离,故答案为:上层;分液;
(4)设得到的乙酸乙酯的物质的量为x,
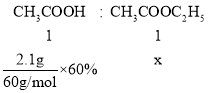
x=0.021mol,m(CH3COOC2H5)=0.021mol×88g/mol≈1.85g,即得到乙酸乙酯的质量为1.85g,故答案为:1.85。


科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下:
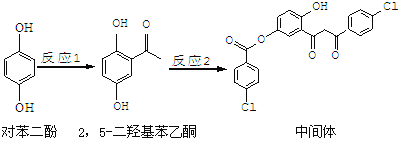
下列说法正确的是
A.对苯二酚和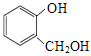 互为同系物
互为同系物
B.1 mol该中间体最多可与7 mol氢氧化钠反应
C.2,5—二羟基苯乙酮能发生加成、水解等反应
D.该中间体分子含有羰基和羟基两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++S![]() +H++OH-BaSO4↓+H2O
+H++OH-BaSO4↓+H2O
B.刻制印刷电路板的反应:Fe3++CuFe2++Cu2+
C.氯气与氢氧化钠溶液反应:Cl2+2OH-Cl-+ClO-+H2O
D.稀硫酸滴到铁片上:2Fe+6H+2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
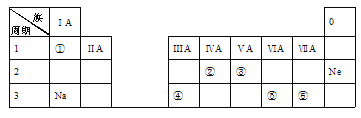
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应I: Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
反应Ⅱ:Al2O3(s)+3C(s) =2Al(g)+3CO(g) ΔH2=bkJ·mol-1
反应Ⅲ:3AlCl(g)=2Al(l)+AlCl3(g) ΔH3
①反应Ⅲ的△H3=____kJ/mol。
②950℃时,铝土矿(Al2O3)与足量的焦炭和C12反应可制得AlCl3。该反应的化学方程式是 _____________________________
(2)在高温条件下进行反应:2Al(l)+AlCl3 (g)![]() 3AlCl(g)
3AlCl(g)
①向图1所示的起始容积相等的两个密闭容器A、B中加入足量的Al粉,再分别充入1molAICl3 (g),在相同的高温下进行反应。图2表示A容器内的AlC13(g)体积分数随时间的变化图,在图2中画出 B容器内AlCl3 (g)体积分数随时间的变化曲线____________。
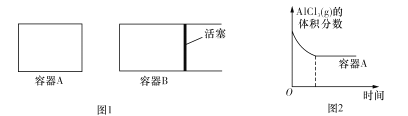
②1 100℃时,向2L密闭容器中通入3mol AlCl(g),发生反应:3AlCl(g)![]() 2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
③加入3 mol AlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。则此反应选择温度为 _____________________
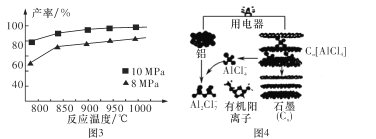
(3)铝可以用来制作快速放电铝离子二次电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl2-和有机阳离子组成电解质溶液,其工作原理如图4所示。
①该电池放电时,AlCl4-向 ___(填“铝电极”或“石墨电极”)方向移动。
②该电池充电时,阴极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:
![]()
(1)上述物质中为红棕色气体的是____(填化学式);
(2)NH3溶于水所得溶液呈___(填“酸性”、 “碱性”或“中性” );
(3)配平NO2→HNO3的化学方程式:3NO2 +H2O = ___HNO3 + NO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
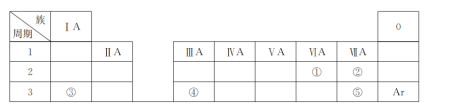
(1)①的元素符号是________;
(2)②和⑤的原子半径大小关系是②________⑤(填“>”“<”或“=”);
(3)③和⑤形成的化合物含有的化学键是__________(填“离子键”或“共价键”);
(4)③、④的最高价氧化物对应的水化物相互反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的正极材料是含锂的钴酸锂(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,用LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com