
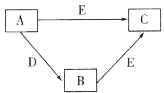
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的一种或几种所组成的物质。已知A分子中含有18个电子,C、D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是
A.Y的简单氢化物的沸点比Z的高
B.X、Y组成的化合物中可能含有非极性键
C.Z的氧化物对应水化物的酸性比W的弱
D.W是所在周期中原子半径最小的元素
【答案】C
【解析】
A分子中含有18个电子,含有18个电子的分子有:Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6、CH3OH等,C、D有漂白性,具有漂白性的物质有Na2O2、O3、H2O2、NaClO、Ca(ClO)2、SO2、活性炭,根据五种物质间的转化关系,A为H2S,B为S,C为SO2,D为H2O2,E为O2,X、Y、Z、W为原子序数依次增大的四种短周期主族元素,则X为H元素,Y为O元素,Z为S元素,W为Cl元素,据此分析解答。
A.Y为O元素,Z为S元素,简单气态氢化物分别为H2O、H2S,由于H2O分子间形成氢键,则Y的简单氢化物的沸点比Z的高,故A正确;
B.X为H元素,Y为O元素,X、Y组成的化合物为H2O和H2O2,H2O中只含有极性共价键,H2O2中既含有极性共价键又含有非极性共价键,故B正确;
C.Z为S元素,W为Cl元素,非金属性越强,最高价氧化物对应水化物的酸性越强,Z的氧化物对应水化物可形成硫酸,W可形成次氯酸,硫酸的酸性强于次氯酸,故C错误;
D.W为Cl元素,同周期元素从左至右,随核电荷数增大原子半径减小,则W是所在周期中原子半径最小的元素,故D正确;
答案选C。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
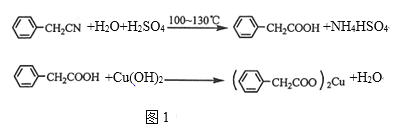
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣﹣纳米氧化铜的重要前驱体之一。
如图1是它的一种实验室合成路线:
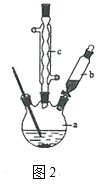
制备苯乙酸的装置如图2所示(加热和夹持装置等略):
已知:苯乙酸的熔点76.5℃,微溶于冷水,溶于热水、乙醇。
回答下列问题
(1)在250mL三口瓶a中加入70mL70%硫酸,将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。
①在装置中,仪器b的作用是_______。
②仪器c的名称是_________,其作用是_______。
③反应结束后与适量冷水混合,混合的操作是_______,与冷水混合的目的是______。
(2)下列仪器中可用于分离苯乙酸粗品的是__________(填字母)。
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯苯乙酸的方法是:将苯乙酸粗产品加入到______进行溶解,然后_____,最后____。最终得到44g纯品,则苯乙酸的产率是_______。
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述错误的是
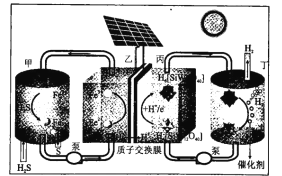
A.丙区发生的电极反应为![]()
B.丁区![]() 在催化剂表面发生电化学反应生成
在催化剂表面发生电化学反应生成![]() 和H2
和H2
C.理论上甲区每生成1molS时通过质子交换膜的H+为2mol
D.该装置实现了利用太阳能间接将H2S分解为S和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2LCHC13中含有的氯原子数目为1.5NA
B.10.0g质量分数为46%的乙醇溶液与足量钠反应产生的H2数目为0.05NA
C.常温常压下,124gP4中含σ键数目为4NA
D.向1L1mol·L-1NH4Cl溶液中加入氨水至中性,溶液中![]() 数目为NA
数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应为M1-XFeXPO4 + Li+ + e- = LiM1-XFeXPO4,其原理如图所示,下列说法正确的是( )
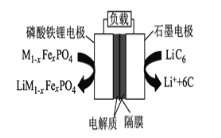
A.放电时电池的总反应为M1-XFeXPO4 + LiC6 =LiM1-XFeXPO4 + 6C
B.放电时,电流由石墨电极流向磷酸铁锂电极
C.充电时,Li+移向磷酸铁锂电极
D.充电时,石墨电极应该接到电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物[Co(NH3)5NO2]Cl2的制备流程如下:
CoCl2·6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+基态核外电子排布式为___。
(2)配合物[Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为___(填元素符号);配离子[Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为___。
(3)NO![]() 的空间构型为___,与它互为等电子体的分子为___(写化学式)。
的空间构型为___,与它互为等电子体的分子为___(写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(5)1mol[Co(NH3)5Cl]Cl2中含有σ键的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的离子方程式为__________。
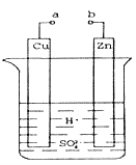
(2)a和b用导线连接,Cu极为原电池_____(填“正”或“负”)极,电极反应式是_______,发生_______(填“氧化”或“还原”)反应。
(3)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______。
(4)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因_____。
(5)如果把硫酸换成硫酸铜溶液,猜测____(填“锌极”或“铜极”)变粗,原因是____(用电极方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com