
【题目】根据所学知识回答下列问题:
(1)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4 =2ClO2↑+O2↑+2Na2SO4+2H2O
①方法一的离子方程式为____________________________________.
②方法二中被氧化的物质是___________,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为___________L,在下面的化学方程式上用双线桥标出电子转移的方向和数目
2NaClO3+H2O2+H2SO4 =2ClO2↑+O2↑+2Na2SO4+2H2O___________
③某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3- 的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为____________;
(2)现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL 0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
①应量取的浓硫酸体积是__________,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有_________________;
②将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)_________________________。
A. 用量筒量取浓硫酸时,仰视量筒的刻度
B. 容量瓶未干燥即用来配制溶液
C. 浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D. 往容量瓶转移时,有少量液体溅出
E. 烧杯未进行洗涤
F. 在容量瓶中定容时俯视容量瓶刻度线
G. 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
【答案】 2ClO3- +4H+ +2Cl- =2ClO2↑+Cl2↑+2H2O H2O2 2.24  3:1 5.4mL 500mL容量瓶 ACF
3:1 5.4mL 500mL容量瓶 ACF
【解析】(1)①方法一的离子方程式为2ClO3- +4H+ +2Cl- =2ClO2↑+Cl2↑+2H2O.
②方法二H2O2中-1价O化合价升高到0价,所以被氧化的物质是H2O2,电子转移的数目为2e-。若反应中有0.1mol电子转移,则产生的ClO2气体的物质的量为0.1mol,在标准状况下的体积为2.24L,用双线桥标出电子转移的方向和数目为:

③某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3- 的浓度之比为1:1。由ClO-与ClO3- 中氯元素的化合价可知,氯元素分别升高了1和5,根据氧化还原反应中电子转移守恒可知,Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为(1+1![]() 5):(1+1)=3:1;
5):(1+1)=3:1;
(2)98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度为18.4mol/L。现用这种浓H2SO4来配制480mL 0.2mol/L的稀H2SO4。由于实验室没有480mL的容量瓶,应选择500mL的容量瓶,并按此规格进行计算,由溶液的稀释定律可得,V(浓硫酸)= ![]() 5.4mL。
5.4mL。
①应量取的浓硫酸体积是5.4mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还有500mL容量瓶;
②将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。A. 用量筒量取浓硫酸时,仰视量筒的刻度,则所量取的浓硫酸体积偏大,所配溶液浓度会偏大;B. 容量瓶未干燥即用来配制溶液,没有影响;C. 浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,则所配溶液体积偏小、浓度偏大;D. 往容量瓶转移时,有少量液体溅出,则所配溶液浓度会偏小;E. 烧杯未进行洗涤,则所配溶液浓度偏小;F. 在容量瓶中定容时俯视容量瓶刻度线,溶液体积偏小、浓度偏大;G. 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,则所配溶液体积偏大、浓度偏小。综上所述,会引起所配浓度偏大操作的ACF。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | 硫酸 | 纯碱 | 石膏 | 铁红 |
B | 氢硫酸 | 烧碱 | 纯碱 | 生石灰 |
C | 碳酸 | 熟石膏 | 小苏打 | 二氧化硫 |
D | 二氧化碳 | 苛性钾 | 食盐 | 石灰石 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3
D.相对分子质量Na2CO3<NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+O2 ![]() 2SO3 , 达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
2SO3 , 达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
A.0.6 mol
B.0.4 mol
C.0.8 mol
D.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(氧氮杂 ![]() 是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂
是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂 ![]() 类化合物H的合成路线:
类化合物H的合成路线: 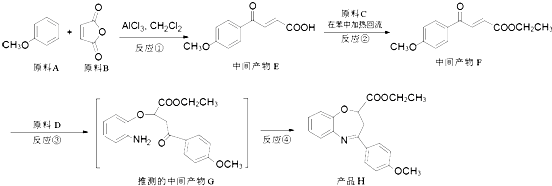
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是(写出其结构简式).
(2)反应②的化学方程式是 .
(3)③的反应类型是 . 原料D中含有的官能团名称是、 .
(4)原料B俗名“马莱酐”,它是马莱酸(顺丁烯二酸: ![]() )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( ![]() )和聚合物Q:
)和聚合物Q: 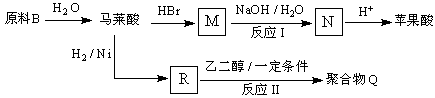
写出反应Ⅰ和反应Ⅱ的化学方程式:、 .
(5)符合下列条件的中间产物F的同分异构体数目是(不考虑手性异构),写出其中任意一种的结构简式 . (i)能发生银镜反应;
(ii)分子中含有三取代的苯环结构,其中两个取代基是:﹣COOCH3和 ![]() ,且二者处于对位.
,且二者处于对位.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( ) 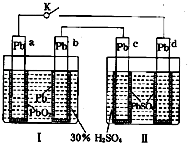
A.K闭合时,d电极反应式:PbSO4+2H2O﹣2e﹣=PbO2+4H++SO42﹣
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42﹣向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com